Перколяция чужеродной ДНК в геном при оплодотворении
|
За последние годы методические приемы получения трансгенных мышей достигли технического совершенства и получили теоретическое обоснование [1]. Именно этим объясняется стремление исследователей при переходе на другие объекты следовать сложившейся методологии. Тем не менее из-за различий в строении и функционировании репродуктивной системы и ряда причин, связанных с индивидуальным развитием, методы трансгенеза, хорошо зарекомендовавшие себя на мышах, трудно реализуются при работе с особями других видов [2]. В этой связи представляется актуальным поиск новых путей получения трансгенных животных. С общебиологической точки зрения наиболее привлекательным выглядит использование сперматозоидов в качестве естественного вектора для переноса чужеродной ДНК (чДНК) в яйцеклетку. Таким способом были созданы трансгенные мыши [3, 4], свиньи [5], куры [6] и пчелы [7], причем эффективность процедуры составляла 30–60% [3, 6, 7]. В ряде случаев было показано, что трансгены способны экспрессироваться и передаваться потомству [3, 6].
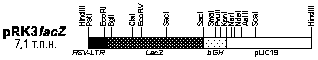
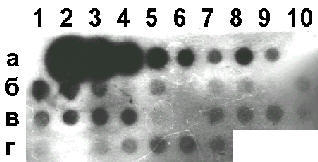
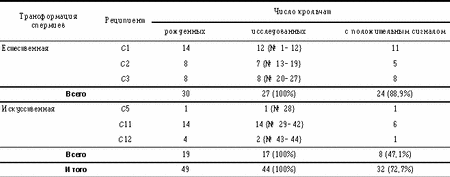
В предшествующих экспериментах мы обрабатывали спермии кролика плазмидой рRK3lасZ, искусственно осеменяли крольчих и наблюдали экспрессию гена lасZ в доимплантационных эмбрионах до стадии морулы включительно [8]. В настоящей работе была предпринята попытка получить трансгенных животных. Поскольку имеются факты, свидетельствующие о существовании в клетках эукариот селекции, которая направлена против вирусных и бактериальных последовательностей ДНК [9, 10], в опытах использовали разные формы плазмиды pRK3lacZ. Материал и методы Конструирование плазмиды pRK3lacZ. Регуляторную область RSV-LTR вырезали из плазмиды pRSV-lacZ [11] рестриктазами NdeI и HindIII, обрабатывали фрагментом Кленова в присутствии dNTP и клонировали в затупленный сайт XbaI плазмиды pUC19. В результате была получена плазмида pRSV1. Концевую область гена bGH с участками сплайсинга и полиаденилирования вырезали из плазмиды pGL3 [12] рестриктазами PstI и KpnI и клонировали в сайт SmaI вектора pUC19 описанным выше способом. Получили плазмиду pK3. Далее плазмиды pRSV1 и pK3 расщепили смесью рестриктаз BamHI и HindIII, выделили фрагменты, содержащие RSV-LTR и bGH-pUC19, а затем лигировали их. Таким образом, получили вектор pRSVK3, содержащий все необходимые участки для транскрипции и созревания молекул мРНК. Из плазмиды pLZ4 [13] с помощью рестриктаз BamHI и SalI вырезали полусинтетический ген b-галактозидазы E. coli. Участок ДНК с геном lacZ обрабатывали фрагментом Кленова и клонировали в предварительно затупленный BamHI-caйт вектора pRSVK3. Полученную плазмиду назвали pRK3lacZ (рис. 1). В экспериментах по трансформации использовали HindIII, KpnI-рестрикты плазмиды pRK3lacZ или смесь кольцевых и линейных молекул ДНК в соотношении 4:1. Подготовка сперматозоидов и осеменение крольчих. Кроличью сперму получали от половозрелых самцов породы советская шиншилла с помощью искусственной вагины. Кроликов содержали в следующем половом режиме: 1 садка не чаще, чем в 3 дня, и не реже, чем в неделю. В эксперименте использовали эякуляты, содержащие не менее 80% подвижных спермиев. Активные сперматозоиды отделяли от неподвижных флотацией в 10-кратном объеме раствора Эрла. Суспензию подвижных клеток дважды центрифугировали при 200 g в течение 5 мин. Осадок ресуспендировали в растворе Эрла (содержит 50 мМ CaCl2 и 100 мМ KCl) и разводили до конечной концентрации 107 клеток в 1 мл. К 500 мкл суспензии добавляли в 50 мкл буфера ТЕ HindIII, KpnI-рестрикты ДНК pRK3lacZ или смесь указанных линейных фрагментов плазмиды с ее кольцевой формой и тщательно перемешивали. Далее сперматозоиды инкубировали 15–30 мин при комнатной температуре (естественная трансформация), либо проводили инкубацию в присутствии 3% диметилсульфоксида (DMSO) с последующей температурной обработкой (4oC ® 42oC, 2 мин) или без нее (искусственная трансформация). Самок в фазе эструса осеменяли при помощи катетера трансформированными спермиями. Сразу после осеменения внутривенно вводили по 100 МЕ хорионического гонадотропина. Контрольные эксперименты осуществляли без использования ДНК pRK3lacZ. Выделение геномной ДНК [14]. Измельченные кусочки тканей (50 мг) инкубировали на качалке при 50оС в течение ночи в 700 мкл раствора следующего состава: 50 мМ Трис-HCl (pH 8,0), 100 мМ EDTA, 100 мМ NaCl, 1% SDS, 100 мкг/мл протеиназы К (“Sigma”, США). Утром добавляли 5 мкл РНКазы А (1 мг/мл, “Sigma”) и инкубировали при 37оС в течение 1 ч. Далее вносили 700 мкл фенола, насыщенного ТЕ, и осторожно перемешивали до гомогенного состояния в течение 20 мин. Фазы разделяли центрифугированием при 8000 об/мин в течение 15 мин. К верхней вязкой водной фазе приливали 700 мкл смеси фенол-хлороформ (1:1, об/об), уравновешенной ТЕ и содержащей 1:50 (об/об) изоамилового спирта, аккуратно перемешивали и центрифугировали при тех же условиях. К верхней фазе добавляли 1 мл 96% этанола, аккуратно перемешивали и осаждали ДНК центрифугированием (8000 об/мин, 15 мин). Осадок промывали 1 мл 70% этанола, снова центрифугировали, подсушивали в вакууме и растворяли в 200 мкл ТЕ, инкубируя на качалке в течение 2 ч при 37 оС. Если величина отношения А260/А280 в образце была ниже 1,7, проводили повторную экстракцию смесью фенол-хлороформ. Целостность высокомолекулярной ДНК проверяли электрофорезом в 0,8% агарозном геле [15]. Подготовка радиоактивного гибридизационного зонда. ДНК pRK3lacZ метили [a-32P]ATP (ИЯФ, Обнинск) при помощи реакции ник-трансляции, используя ник-набор фирмы “Fermentas” (Литва), согласно инструкции производителя. Активность ДНК [32P]-pRK3lacZ составляла 1010 имп/минЧмл. К зонду добавляли ДНК из спермы лосося (100 мкг/мл) и денатурировали на кипящей водяной бане в течение 10 мин. Иммобилизация хромосомной ДНК на фильтре [16]. Капроновые мембраны “Хииу-калур” (Эстония) предварительно выдерживали 15 мин в 10ґSSPE. ДНК-пробу (10 мкг) и контрольные разведения плазмиды pRK3lacZ смешивали с 10 мкг ДНК из спермы лосося, денатурировали нагреванием в течение 10 мин при 95оС и наносили в точки при помощи прибора Dombi-Dot (Диа-М, Россия). Связанную ДНК пришивали к высушенным фильтрам под УФ-лампой на расстоянии 15 см в течение 20 с. Рестрикция хромосомной ДНК эндонуклеазой EcoRI, Саузерн-блотинг [15]. Образцы ДНК по 10 мкг гидролизовали 200 ед. рестриктазы EcoRI при 37°С в течение ночи и разделяли при помощи электрофореза в 0,8% агарозе. Денатурацию ДНК в геле проводили в течение 1 ч с помощью буфера, содержащего 0,5 М NaOH, 1,5 M NaCl. Далее гель нейтрализовали в буфере: 1 М Трис-HCl (pH 8,0), 1,5 M NaCl. Капиллярный перенос ДНК-фрагментов на нейлоновые фильтры Hybond-N (“Amersham”, Англия) осуществляли с помощью 10ґSSC в течение 12 ч. Гибридизация и радиоавтография [17]. Предгибридизацию проводили в течение 2 ч при 65оС в растворе следующего состава: 5ґSSPE, 0,3% SDS, 100 мкг/мл ДНК из спермы лосося. Гибридизацию с зондом осуществляли в том же растворе при 65оС в течение ночи. Фильтр четырежды отмывали при 45оС по 10 мин в 250 мл раствора: 2ґSSPE, 0,2% SDS. Радиоавтографию проводили с рентгеновской пленкой РМ-1 (“Тасма”, Россия) в присутствии усиливающих экранов в течение 1 и 4 нед при –20оС. Определение b-галактозидазной активности. Ферментативную активность бактериальной b-галактозидазы (КФ 3.2.1.23) определяли по цветной реакции с хромогенным субстратом CPRG (“Boehringer Mannheim”, Германия). Для этого сыворотку крови анализируемых животных смешивали в соотношении 1:4 (об/об) с раствором следующего состава: 3,29 мМ CPRG, 150 мМ NaCl, 2 мМ MgCl2, 0,1% NaN3 (масса/об), 1% BSA (масса/об), 150 мкг/мл хлороквина, 100 мМ HEPES (pH 7,0) и инкубировали при 30 оС в течение ночи. Интенсивность окрашивания оценивали спектрофотометрически (l=574 нм). Результаты Общие итоги опыта, результаты точечной гибридизации с зондом [32P]-pRK3lacZ. Эксперименты по обнаружению перенесенной спермиями кролика ДНК pRK3lacZ у новорожденных особей, взрослых животных и их потомков проводили в 1992–1993 гг. Опробовали приемы естественной и искусственной трансформации сперматозоидов. Было проведено 3 серии опытов. Серия 1. Эякулят получали от кроликов № 1–4. Отмытые от семенной жидкости сперматозоиды инкубировали с HindIII, KpnI-рестриктами плазмиды pRK3lacZ (5–10 мкг/мл) в течение 15–30 мин при комнатной температуре в растворе Эрла. После этого суспензию клеток разбавляли тем же раствором и проводили искусственное осеменение. Из 10 самок животные A2, A3, A8 и A9 родили 26 крольчат, которые были исследованы при помощи дот-гибридизации на содержание чужеродных последовательностей ДНК. Положительные сигналы зарегистрированы не были. Серия 2. В опыте использовали сперму от самцов № 2—4. После флотации и отмывки клеток от семенной плазмы в растворе Эрла к ним дробно добавляли DMSO — сначала до 1%, а через 10 мин инкубации спермиев при комнатной температуре с 10 мкг/мл плазмиды pRK3lacZ, линеаризованной по HindIII и KpnI сайтам, – до 3%. Затем суспензию охлаждали в течение 20 мин до 4oC и проводили тепловой шок (42oC, 2 мин). В результате осеменения крольчих D7–D14 было получено 35 крольчат, из которых 29 особей исследовали с помощью дот-гибридизации. Как и в предыдущем случае, позитивные животные выявлены не были. Серия 3. С целью отмыть спермии от семенной жидкости эякуляты кроликов № 3–5 обрабатывали при помощи флотации и центрифугирования. Во всех вариантах опыта трансформацию сперматозоидов проводили в 500 мкл раствора Эрла в присутствии 2,5 мкг HindIII, KpnI-рестриктов плазмиды pRK3lacZ и 10 мкг кольцевой ДНК pRK3lacZ. В первом случае после 30 мин инкубирования суспензии клеток и ДНК при комнатной температуре были осеменены 3 самки: C1, C2 и C3. Во втором - к отмытым сперматозоидам сначала добавили DMSO до 1%, затем ДНК, после этого смесь проинкубировали в течение 10 мин, добавили DMSO до 3% и инкубировали еще 20 мин при комнатной температуре. Трансформированными спермиями обработали крольчих № C4–C6. В третьем случае после добавления DMSO до 1% и соответствующего количества ДНК, последующего инкубирования в течение 10 мин при комнатной температуре и повторного добавления DMSO до 3%, смесь охлаждали до 4o C в течение 20 мин и затем нагревали до 42o C за 2 мин. Трансформантами осеменили самок № C7–C12, часть из которых принесла потомство. Всего от крольчих № C1–C12 было получено 49 детенышей, из них 44 исследованы при помощи дот-гибридизации. В 32 (72,7%) случаях при гибридизации с зондом [32P]-pRK3lacZ зарегистрирован положительный сигнал (см. таблицу). В этих образцах обнаружено 0,1–1 пг искомой ДНК на 10 мкг хромосомной ДНК, что составляет менее 1 копии плазмиды pRK3lacZ на геном (~0,04–0,4). Зонд не гибридизовался с ДНК из контрольных животных (рис. 2). Рис. 1. Физическая карта плазмиды pRK3lacZ.
Плазмида pRK3lacZ состоит из следующих частей: 3ў-фрагмент длинного концевого повтора провируса саркомы Рауса (RSV-LTR), который содержит сигналы инициации транскрипции; полусинтетический ген lacZ, кодирующий бактериальный фермент b-галактозидазу; 3ў-концевой участок гена гормона роста быка (bGH), содержащий сигналы сплайсинга, полиаденилирования и терминации транскрипции; вектор pUC19. Рис. 2. Дот-гибридизация зонда [32P]-pRK3lacZ с хромосомной ДНК.
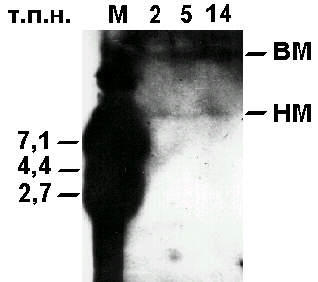
Рис. 3. Блот-гибридизация с хромосомной ДНК, гидролизованной рестриктазой EcoRI
Интеграция в геном интродуцированной последовательности ДНК. Хромосомная ДНК из ушей 9 крольчат в возрасте 1 мес (№ 2, 5, 6, 14, 26, 28, 29, 34 и 43) была гидролизована рестриктазой EcoRI, а потом исследована при помощи Саузерн-блотинга и гибридизации с зондом [32P]-pRK3lacZ. В пробах 2, 5, 6 (5ґC1), 14 (5ґC2) и 26 (5ґC3) обнаружено по два утяжеленных фрагмента: более 23 т.п.н. и около 10 т.п.н. (рис. 3), что свидетельствует о присутствии в составе последовательности экзогенной ДНК одного EcoRI-сайта (см. рис. 1) и может указывать на сайт-специфическую интеграцию 1 копии трансгена с геномом. Помимо этого, отмечено слабое распределение сигнала в области, заключенной между указанными рестриктами. Такая картина характерна для рассеянных по геному повторов. Проведенная Н.А. Зиновьевой в лаборатории G. Brem (Германия) гибридизация этой же ДНК с радиоактивным SacI-фрагментом гена lacZ длиной 1121 п.н. также привела к засветке радиоавтографов. От позитивных кроликов: самца № 8 и самки № 2 по достижении ими половой зрелости было получено потомство. Хромосомную ДНК из ушей крольчат № 50–56 (F1) гибридизовали с меченой плазмидой pRK3lacZ, однако положительных сигналов не обнаружено. У животных № 1–8, 14, 15 в возрасте 6 мес из ушей снова была выделена хромосомная ДНК и проанализирована с помощью дот-гибридизации на присутствие последовательности pRK3lacZ. Результат оказался отрицательным. Негативные результаты были получены также Т.С. Денисовой (ВНИИ СХБ, Москва) при Саузерн-анализе этих проб. Из печени, селезенки, почек, сердца, легких, мышцы, мозга и семенника кролика № 21 в возрасте 6 мес была выделена высокомолекулярная ДНК и гибридизована в точках с зондом pRK3lacZ. Слабые сигналы были зарегистрированы в печени, селезенке и почках. Отсутствие фенотипического выражения гена lacZ у трансгенных особей. Продукт экспрессии гена lacZ искали в сыворотке крови 6-месячных подопытных животных № 1–8, 14, 15 и 21 при помощи цветной реакции с хромогенным субстратом b-галактозидазы – CPRG; активность бактериальной b-галактозидазы не обнаружена. Фенотип животных не зависел от копийности трансгена и находился в пределах нормы (см. рис. 2, рис. 4). Итоги серии опытов №3.
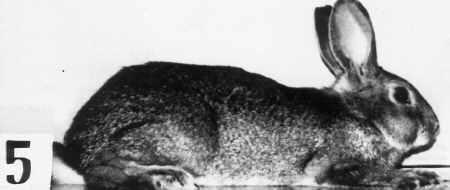
Рис. 4. Кролики № 2, 5 и 14, полученные при помощи трансформированных сперматозоидов, в возрасте 6 мес.
Обсуждение В описанных экспериментах были опробованы разные сочетания способов трансформации сперматозоидов кролика (естественная, искусственная) и конформации ДНК (линейная, линейная + кольцевая). Чужеродные последовательности ДНК были зарегистрированы у животных месячного возраста только в случае использования смеси линейной и кольцевой форм плазмиды pRK3lacZ. Влияние топологии ДНК на эффективность ее переноса спермиями в яйцеклетки было отмечено нами ранее в экспериментах по транзиентной экспрессии последовательности pRK3lacZ в доимплантационных зародышах [18] и может указывать на упаковку чДНК в сперматозоидах в форме ротаксанов. Высокая (72,7%) частота обнаружения последовательности pRK3lacZ в потомстве крольчих, осемененных трансформированными сперматозоидами, также согласуется с результатами экспериментов по выявлению экспрессии индикаторного гена lacZ в доимплантационных эмбрионах [8]. Аналогичные результаты (~60% трансгенных особей) были получены другими авторами на курах [6] и пчелах [7]. Отметим, что более низкая доля появления позитивных особей при искусственной трансформации (47,1%) по сравнению с естественной (88,9%) может быть следствием гибели развивающихся эмбрионов (см. таблицу). Следует отметить что, как в работах J. De la Fuente и соавт. [4] и C. Milne и соавт. [7], в наших экспериментах экзогенная последовательность была обнаружена в геноме рожденных животных в малом числе копий (~0,04–0,4). При обработке хромосомной ДНК позитивных животных эндохромосомной ДНК позитивных животных эндонуклеазой EcoRI и последующей гибридизации с линеаризованной плазмидой pRK3lacZ в качестве зонда вместо ожидаемых фрагментов размером 7,1 или 4,4 т.п.н. на блотах обнаружены по два высокомолекулярных рестрикта и слабая “засветка” между ними (см. рис. 3). Возможно, встраивание трансгена произошло в предпочтительное место повторяющейся последовательности, разбросанной по геному. Зарегистрировано не более 1 акта интеграции на клетку и потеря интродуцированной ДНК у 6-месячных животных. Плазмида pRK3lacZ не экспрессировалась, имела мозаичное распределение по тканям, не передавалась потомству и, возможно, была перестроена. Этот результат может быть следствием интеграции чужеродной ДНК в область нестабильных повторов либо указывать на ее персистенцию в автономном состоянии в виде высокомолекулярных ковалентно замкнутых структур. Полученные данные не исключают того, что в геном кроликов включилась только часть интродуцированной ДНК. В литературе известен пример дифференцированного выщепления аденовирусной ДНК из соматических клеток трансгенных мышей [19]. Потеря вирусной последовательности RSV-LTR в результате встраивания плазмиды pMA3 в геном мыши была описана ранее В.З. Тарантулом и соавт. [9]. В этой же работе приводятся факты интеграции микроинъецированной ДНК в эволюционно-консервативную повторяющуюся последовательность. В экспериментах G. Zoraqi и C. Spadafora [20] была зафиксирована интеграция фрагмента плазмиды pSV2cat в уникальный сайт генома спермия мыши вблизи консенсусной последовательности для топоизомеразы II. Определяющая роль разрывов ДНК под действием топоизомеразы II в событии незаконной интеграции была доказана A. Bodley и соавт. [21] на примере клеток, инфицированных вирусом SV-40. Эти исследователи продемонстрировали факт интеграции вирусной ДНК в геном клетки-хозяина с последующим формированием высокомолекулярных комплексов ДНК. G. Zoraqi и C. Spadafora [20] наблюдали появление сходных высокомолекулярных компонентов в результате инкубации сперматозоидов мыши с плазмидной ДНК pSV2cat. Авторы подчеркивают, что такие структуры скорее представляют продукты рекомбинации, чем мультимерные формы плазмид, так как они не расщеплялись до мономеров в результате рестрикции по HindIII-сайту, расположенному в плазмиде pSV2cat. Подобные высокомолекулярные комплексы, устойчивые к EcoRI-рестрикции, обнаружены и в наших экспериментах с плазмидой pRK3lacZ на кроликах (см. рис. 3). Таким образом, приведенные в настоящей работе факты свидетельствуют о том, что перенос чДНК сперматозоидом в ооцит и ее интеграция с хозяйской ДНК – контролируемые спермием и яйцеклеткой процессы. По этому поводу высказывалось мнение, что способность чДНК включаться в геном зависит от уровня ретровирусной активности в ранних эмбрионах [22]. Полученные нами результаты подтверждают данные о том, что чужеродные последовательности ДНК способны перколировать (“просачиваться”) в геном зиготы при оплодотворении [3–7]. Не исключено, что в процессе интеграции чДНК с хромосомой некоторые последовательности ДНК получают селективное преимущество. Дальнейшие исследования должны пролить свет на механизм включения привнесенной спермием ДНК в геном зиготы. Знания, полученные в этой области, не только необходимы для оптимизации процедуры трансформации сперматозоидов с целью получения трансгенных животных, но и могут быть полезны при определении нормативов для оплодотворения in vitro в клинике, а также для более глубокого понимания эволюционных и генетических процессов. Авторы считают своим долгом выразить признательность В.А. Сигаевой, Н.А. Зиновьевой и Т.С. Денисовой за содействие, И.В. Беликовой и Ж.В. Калмыковой за помощь в работе с животными. Литература 1. Grosveld F., Kollias G. Transgenic animals. London: Academic Press 1992; 277. 2. Wall R.J., Seidel Jr. Transgenic farm animals – a critical analysis. Theriogenology 1992; 38: 337–357. 3. Lavitrano M., Camaioni A., Fazio V.M., Dolci S., Farace M.G., Spadafora C. Sperm cells as vectors for introducing foreign DNA into eggs: genetic transformation of mice. Cell 1989; 57: 717–723. 4. De la Fuente J., Castro F.O., Hernandez O., Guillen I., Ullver C., Solano R., Milanes C., Agullar A., Lleonart R., Martinez R., Perez A., de Armas R., Herrera L., Limonta J., Cabrera E., Herrera F. Sperm mediated foreign DNA transfer experiments in different species. Symposium Biotech. Washington USA 1990. 5. Gandolfi F., Lavitrano M., Camaioni A., Spadafora C., Siracusa G., Lauria A. The use of sperm-mediated gene transfer for the generation of transgenic pigs. J Reprod Fert Abstr 1989; 4: 21. 6. Gruenbaum Y., Revel E., Yarus S., Fainsod A. Sperm cells as vectors for generation of transgenic chickens. J. Cell Biochem. 1991; Suppl. 15E: 194. 7. Milne C.P., Jr., Elschen F.A., Collis J.E., Jensen T.L. Preliminary evidence for honey bee sperm-mediated DNA transfer. International Symposium on Molecular Insects Science. Tucson USA 1989; 3–7. 8. Кузнецов А.В., Кузнецова И.В. Связывание экзогенной ДНК pRK3lacZ сперматозоидами кролика, ее перенос в ооциты и экспрессия в доимплантационных эмбрионах. Онтогенез 1995; 26: 4: 300–309. 9. Тарантул В.З., Кучерявый В.В., Макарова И.В., Баранов Ю.Н., Бегетова Т.В., Андреева Л.Е., Смирнова М.Б., Газарян К.Г. Клонирование фрагмента ДНК трансгенной мыши, содержащий интегрированную рекомбинантную плазмиду. Молекул биол 1986; 20: 1: 278–286. 10. Gasser C.S., Simonsen C.C., Schilling J.W., Schimke R.T. Expression of abbreviated mouse dihydrofolate reductase genes in cultured hamster cells. Proc Natl Acad Sci USA 1982; 79: 21: 6522–6526. 11. Клонирование ДНК. Методы. Под ред. Д. Гловера М: Мир 1988; 538. 12. Газарян К.Г., Андреева Л.Е., Серова И.А., Тарантул В.З., Кузнецова Е.Д., Хайдарова Н.В., Генинг Л.В., Кузнецов Ю.М., Газарян Т.Г., Смирнов А.Ф., Козикова Л.В., Ефимов А.М. Получение трансгенных кроликов и мышей, содержащих ген гормона роста быка. Молекул генетика 1988; 10: 23–26. 13. Коробко В.Г., Добрынин В.Н., Нгуен Куанг Винь, Подладчикова О.Н., Северцова И.В., Быстров Н.С., Болдырева Е.Ф., Чувпило С.А., Колосов М.Н. Плазмидные векторы с полусинтетическим геном b-галактозидазы E.coli. Биоорган химия 1983; 9: 9: 1285–1289. 14. Новое в клонировании ДНК. Методы. Под ред. Д. Гловера М: Мир 1989; 368. 15. Маниатис Т., Фрич Э., Сэмбрук Дж. Молекулярное клонирование. М: Мир 1984; 480. 16. Методы молекулярной генетики и генной инженерии. Под. ред. Р.И. Салганика Новосибирск: Наука, 1990; 248. 17. Девис Р., Ботстайн Д., Рот Дж. Методы генетической инженерии. Генетика бактерий. М: Мир 1984; 155. 18. Кузнецов А.В., Кузнецова И.В. Попытки получения трансгенных животных с помощью подвижных векторов. Генноинженерные сельскохозяйственные животные: Сборник научных трудов. (Выпуск 1). РАСХН. М 1995; 173–180. 19. Тарантул В.З., Кузнецова Е.Д., Андреева Л.Е., Серова И.А., Газарян К.Г. Дифференцированное выщепление аденовирусной ДНК из соматических клеток трансгенных мышей. Онтогенез 1988; 19: 4: 443 . 20. Zoraqi G., Spadafora C. Integration of foreign DNA sequences into mouse sperm genome. DNA and Cell Biology 1977; 16: 3: 291–300. 21. Bodley A.L., Huang H.C., Yu C., Liu L.F. Integration of Simian virus 40 into cellular DNA occurs at or near topoisomerase II cleavage hot spots induced by VM-26 (teniposide). Mol Cell Biol 1993; 13: 6190–6200. 22. Erickson R.P. Are intermediate vectors needed between foreign DNA on sperm and the nucleus? Immunology Today 1990; 6: 2: 31. А.В. Кузнецов, А.Б. Жаданов, И.В. Кузнецова, И.Ю. Щит ГНЦ прикладной микробиологии, Оболенск, Московская область, Институт молекулярной биологии РАН, Москва |