Негативное действие экзогенной ДНК на оплодотворение
Негативной стороной трансгенеза является повышенная эмбриональная и постнатальная смертность, а также пониженная жизнеспособность животных [1]. Часть особей бывают стерильными. Введение чужеродной ДНК может приводить к хромосомным аберрациям. Так, у трансгенных мышей описаны хромосомные делеции и дупликации [2], а у трансгенного кролика в лимфоцитах крови был обнаружен клон с добавочной хромосомой – мелким субметацентриком [3]. Сообщалось, что в экспериментах на Danio rerio после микроинъекции рекомбинантных конструкций выявлены общие и специфические типы нарушений эмбрионального развития, вызванные активностью введенной ДНК в зародышевых клетках. При использовании ДНК рmMT1-bGH и pRSV-bGH обнаружена дозовая зависимость в появлении аномалий эмбрионального развития. Отмечено, что число уродств возрастало при использовании RSV-промотора по сравнению с использованием mMT1 [4]. В опытах по переносу полной последовательности ДНК вируса саркомы Рауса (RSV) с помощью сперматозоидов в ооциты Xenopus laevis до 30% 7-дневных зародышей лягушки демонстрировали индуцированные пороки развития (дефекты глаз и головы, отеки, осевые деформации и т.д.). С помощью иммунохимического анализа срезов тканей дефектных животных удалось выявить структурные изменения, дезинтеграцию актиновых филаментов и увеличение экспрессии белка рр60src в миобластах и клетках мезенхимы [5]. Возникает вопрос: существуют ли механизмы защиты от проникновения экзогенной ДНК в геном при оплодотворении? Ранее было отмечено присутствие слабой нуклеазной активности в семенной жидкости хряка [6] и кролика [7]. Помимо этого охарактеризован белковый фактор IF-1 [8], препятствующий связыванию экзогенной ДНК со спермиями. В экспериментах по переносу чужеродных генов сперматозоидами кролика мы столкнулись с частой дегенерацией доимплантационных эмбрионов. Было резонным исследовать последствия воздействия чужеродных ДНК (чДНК) на сперматозоиды и доимплантационные эмбрионы кролика, полученные после искусственного осеменения трансформированными спермиями.
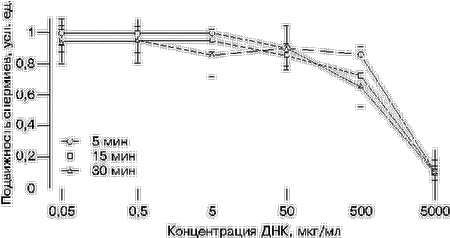
МАТЕРИАЛ И МЕТОДЫВ опытах использовали кроликов породы советская шиншилла. Сперму брали от самцов-доноров при помощи искусственной вагины. Клетки отмывали от семенной жидкости в растворе Эрла или среде Хенкса. Активные спермии отделяли от неподвижных методом флотации. Конечная концентрация мужских гамет в суспензии составляла 107 в 1 мл [9, 10]. Сперматозоиды кролика инкубировали в среде Хенкса при комнатной температуре в течение 5, 15 и 30 мин в присутствии возрастающих концентраций бычьего сывороточного альбумина (БСА) – от 50 нг/мл до 5 мг/мл, гепарина – от 0,01 до 1000 Ед/мл или ДНК из спермы лосося – от 50 нг/мл до 5 мг/мл, которую в ряде случаев обрабатывали ультразвуком (озДНК). Регистрировали подвижность спермиев и оценивали ее в условных единицах (усл. ед.). Трансформацию сперматозоидов ДНК осуществляли по ранее описанной методике [7, 11]. Применяли озДНК из спермы лосося в концентрации 0,5 мг/мл, либо линейные и/или кольцевые формы плазмид рRК3lасZ (предоставлена А.Б.Жадановым) и рСМVlасZ (получена от П.М. Чумакова) в концентрации 5–10 мкг/мл. Суперовулированных крольчих осеменяли суспензией трансформированных спермиев. Через 48 ч после осеменения из яйцеводов вымывали доимплантационные эмбрионы. Детекцию экспрессии экзогенной ДНК в ранних зародышах проводили с помощью методики окрашивания Х-gal [12]. Жизнеспособность эмбрионов определяли по степени развития морулы, морфологическому состоянию их клеточного комплекса и соответствию стадии развития зародыша возрасту от момента осеменения крольчихи-донора до извлечения змбриона. РЕЗУЛЬТАТЫУменьшение подвижности сперматозоидов в присутствии посторонней ДНК. При изучении влияния разных концентраций ДНК из спермы лосося на мужские гаметы кролика было отмечено, что инкубация сперматозоидов в течение 5, 15 или 30 мин с высокими концентрациями ДНК (0,5 и 5 мг/мл) вызывает значительное уменьшение подвижности клеток по сравнению со спермиями, на которые действовали низкими (от 50 нг/мл до 50 мкг/мл) концентрациями ДНК. Физическая причина уменьшения двигательной активности сперматозоидов из-за увеличения вязкости раствора с возрастанием концентрации ДНК исключается, так как аналогичный эффект давал обработанный ультразвуком полимер ДНК с длиной фрагментов менее 1000 пар нуклеотидов (рис. 1). Следовательно, влияние ДНК на активность мужских гамет имеет химическую природу. Добавим, что в аналогичных экспериментах БСА в концентрации до 5 мг/мл включительно не оказывал на подвижность спермиев никакого влияния; в противоположность этому гепарин в концентрации 1000 Ед/мл вызывал резкое снижение двигательной активности сперматозоидов, вплоть до их остановки.
Таблица 1. Результаты оплодотворения после обработки спермиев кролика 0,5 мг/мл озДНК
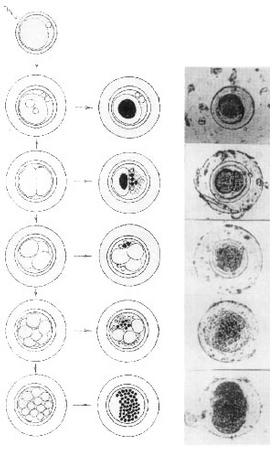
Блокировка оплодотворения экзогенной ДНК.Далее изучали влияние на оплодотворение предварительной обработки спермиев кролика озДНК из спермы лосося, концентрация которой составляла 0,5 мг/мл (см. таблицу). После осеменения спермиями, импрегнированными озДНК, в опыте получили 181 эмбрион, из которых 155 (85,6%) оказались не оплодотворены (отсутствовало второе полярное тельце). В экспериментах без использования ДНК количество неоплодотворенных яйцеклеток составило 35,6%. Было отмечено, что 64,4% контрольных и 14,3% опытных зародышей развились нормально. И в опыте и в контроле стадия развития эмбрионов 8–16 бластомеров соответствовала возрасту вымытых зародышей – 48 ч. В обеих группах отставание в дроблении, которое в большинстве случаев свидетельствует о начале дегенерации эмбриона, не наблюдали. У нормально дробившихся контрольных и опытных зародышей не было видимых морфологических отклонений. Отмечено равномерное развитие и симметричное расположение бластомеров. Перивителлиновое пространство было прозрачным, деформаций и повреждений zona pellucida не зарегистрировано. В опыте замечен 1 дегенерировавший эмбрион с полным разрушением бластомеров. Появление аномальных эмбрионов после оплодотворения трансформированными спермиями.Исследовали морфологию окрашенных Х-gal эмбрионов, которых получили после осеменения крольчих спермиями, обработанными плазмидой рRК3lасZ. Выделен ряд нарушений развития доимплантационных эмбрионов кролика, связанных с остановками в развитии и фрагментацией отдельных бластомеров (рис. 2). Определенная доля яйцеклеток оставалась неоплодотворенной. Остановки развития наблюдали на разных стадиях деления зародышей; значительная часть зигот останавливалась на 1-клеточной стадии. Были обнаружены 2-клеточные зародыши с фрагментацией одного из бластомеров. Идентифицированы 4- и 8-клеточные зародыши с частичным разрушением бластомеров. Также найдены неравномерно развивающиеся эмбрионы (3- и 5-клеточные) с фрагментацией отдельных бластомеров. Выявлены зародыши с полным разрушением эмбриональных тканей (полная фрагментация). У некоторых эмбрионов наблюдали дефекты zona pellucida и помутнение перивителлинового пространства. В редких случаях у зародышей можно было отметить отделение бластомеров и полную потерю прозрачной оболочки. Нельзя утверждать, что причиной этих аномалий является экспрессия гена lасZ, так как подобные морфологические нарушения, но без окрашивания, встречались и у контрольных зародышей.
Итоги опытов с плазмидами рRК3lасZ и pСМVlасZ.В серии экспериментов с рекомбинантными генетическими конструкциями было исследовано 284 доимплантационных эмбриона кролика, полученных в результате осеменения самок сперматозоидами, трансформированными плазмидой рRК3lасZ, и 98 зародышей после трансформации ДНК рСМVlасZ. В результате обработки эмбрионов хромогенным субстратом b-галактозидазы – Х-gal в первом случае зарегистрирован 131 (46,1%) окрашенный зародыш, а во втором – 39 (39,8%). При этом, когда использовали плазмиду рRК3lасZ, нормальный ритм дробления демонстрировали 125 (44%) эмбрионов, а в случае рСМVlасZ – 20 (20,4%). В обоих случаях отмечены значительные задержки в развитии эмбрионов (от одноклеточного до морулы) и примеры дегенерации зародышей (с частичным или полным разрушением эмбриональных тканей). У некоторых эмбрионов наблюдали дефекты или полную потерю блестящей оболочки, помутнение перивителлинового пространства, отделение и нарушение симметрии расположения бластомеров. Таким образом, при использовании ДНК рСМVlасZ количество аномалий составляло 79,6% и было больше, чем в случае применения плазмиды рRК3lасZ (56%). Кроме того, при работе с ДНК рRК3lасZ обнаружено, что 36,4% нормально дробящихся эмбрионов на стадии морулы окрашиваются Х-gаl, а среди зародышей с задержкой в развитии доля окрашенных эмбрионов составила 58,9%. ОБСУЖДЕНИЕБлокировка проникновения экзогенной ДНК в зиготу по принципу отрицательной обратной связи. Полученные данные свидетельствуют, что экзогенная ДНК может оказывать негативные эффекты в отношении сперматозоидов. Например, нами отмечено резкое снижение двигательной активности спермиев кролика при увеличении концентрации ДНК более 500 мкг/мл (см. рис. 1). Гепарин, рецепторы которого обнаружены на сперматозоидах млекопитающих [13], который является аттрактантом для спермиев мыши [14] и, по нашим данным, конкурирует с ДНК за участки связывания на поверхности спермиев кролика [9, 12], оказывал аналогичное действие в концентрации 1000 Ед/мл. Кроме того, при осеменении крольчих сперматозоидами, преинкубированными с высокой концентрацией озДНК из спермы лосося, значительно увеличивалось число неоплодотворенных яйцеклеток (см. табл. 1), при этом в экспериментах с применением низкой концентрации ДНК (5–10 мкг/мл) уровень оплодотворяемости яйцеклеток соответствовал норме (данные не представлены). Предполагаемой причиной потери спермиями оплодотворяющей способности может быть связывание ДНК с соответствующими рецепторами на поверхности сперматозоида, например, молекулами МНСII, участвующими в межклеточном узнавании при оплодотворении [15, 16]. Эффект ингибирования оплодотворения высокими концентрациями ДНК может выполнять функцию защиты от чужеродной ДНК – возрастание концентрации посторонней ДНК в окружающей среде приводит к насыщению рецепторов МНСII, последующей блокировке оплодотворения и, по принципу отрицательной обратной связи, предотвращает проникновение экзогенной ДНК в зиготу вместе со сперматозоидом.
С другой стороны, известно, что сперматозоиды млекопитающих, отмытые от семенной плазмы, способны спонтанно связывать молекулы экзогенной ДНК, которая затем проникает в ядра мужских гамет [17]. В экспериментах В.Маiоnе и соавт. [18] с помощью Southern-блот анализа было показано, что интернализованная ДНК специфически расщепляется эндонуклеазами сперматозоидов мыши, что созвучно с нашими опытами на спермиях кролика, быка и человека [10]. Нуклеазы активировались в ответ на проникновение экзогенной ДНК в сперматозоиды мыши, причем их активность увеличивалась в соответствии с возрастанием концентрации чДНК. Активация нуклеаз была эффективнее в эпидидимальных клетках по сравнению с эякулированными отмытыми сперматозоидами. Нуклеазная активность зависела от ионов Са2+ и ингибировалась ауринтрикарбоновой кислотой или активировалась Са2+-ионофором А23187, которые, как известно, соответственно ингибируют и активируют апоптоз в соматических клетках. Более того, активация нуклеаз являлась причиной частичной деградации эндогенной хромосомной ДНК спермиев: расщепленные фрагменты ДНК высвобождались из сперматозоидов в среду. Обобщая эти данные B.Маiоnе и соавт. [18] делают вывод, что в результате взаимодействия с зкзогенной ДНК в ядрах зрелых сперматозоидов включаются метаболически активные процессы, сходные с апоптозом. В этой же работе показано, что активность нуклеаз в эпидидимальных сперматозоидах мыши может быть индуцирована малыми количествами экзогенной ДНК (10 нг/106 спермиев), в эпидидимальных спермиях хряка – умеренным количеством ДНК (40 нг/106 спермиев), а в эякулированных сперматозоидах хряка только более высокими концентрациями ДНК (500 нг/106 спермиев). Результаты, представленные В.Маiоnе и соавт. [18], существенно дополняют наши данные и способствуют пониманию процессов, лежащих в основе опосредованного спермиями переноса генов. Активация нуклеаз в зрелых сперматозоидах может являться причиной деградации хромосомной ДНК, а также снижения оплодотворяемости и выживаемости, поглотивших чДНК сперматозоидов. Такой эффект способен вызвать негативную селекцию, направленную на пул спермиев, нагруженных чДНК, и сделать предпочтительным оплодотворение клетками, свободными от экзогенной ДНК. Так, в экспериментах по обработке спермиев кролика высокими концентрациями озДНК (0,5 мг/мл) мы наблюдали блокировку оплодотворения (85,6%) и почти не отмечали аномалий в развитии немногочисленных эмбрионов (0,1%) (см. таблицу). В.Маiоnе и соавт. [18] предполагают, что активация эндогенных нуклеаз в зрелых сперматозоидах играет определенную роль в элиминации измененных зародышевых клеток, представляющих потенциальную опасность для развития потомства или генетической целостности организма. Возможный апоптоз в ранних эмбрионах.В экспериментах по переносу рекомбинантных плазмид рRК3lасZ и рСМVlасZ в яйцеклетки кролика с помощью сперматозоидов выявлены задержки развития, дегенерация и гибель доимплантационных эмбрионов (см. рис. 2). При использовании ДНК рRК3lасZ отмечена корреляция между появлением аномальных эмбрионов и присутствием в них b-галактозидазной активности (рис. 3). Доля дефектных эмбрионов в случае ДНК рСМVlасZ составила 79,6%, а для рRК3lасZ – 56%. С одной стороны, аномалии развития эмбрионов в опытах с рекомбинантными ДНК могут быть связаны с экспрессией перенесенных спермиями конструкций и зависеть от типа промотора – при использовании генетической конструкции с СМV-промотором число нарушений развития зародышей было больше, чем для RSV-LТR-промотора. С другой стороны, при обработке сперматозоидов рекомбинантными ДНК в концентрации 5–10 мкг/мл в ряде случаев у доимплантационных эмбрионов кролика были выявлены характерные морфологические признаки апоптоза (отчетливая фрагментация цитоплазмы), ранее обнаруженные у зародышей человека [19]. Мы предполагаем, что причиной индукции апоптоза в ранних эмбрионах может быть деградация как экзогенной, так и хозяйской ДНК в сперматозоидах. Данное предположение основано на представлении о роли белка р53 в остановке и переключении клеточного цикла для репарации или дальнейшего развития клетки по пути апоптоза при появлении разрывов в хромосомной ДНК [20]. Известно, что С-концевой домен белка p53 способен связываться с концами поврежденной ДНК, и это взаимодействие приводит к изменению его конформации и активности, а также к накоплению в ядрах клеток [21]. Протеин р53 может служить одновременно внутриклеточным сенсором разрывов ДНК in vivо, переключателем клеточного цикла и обеспечивать репарацию ДНК. При появлении разрывов в хромосомной ДНК белок р53 на некоторое время останавливает клеточный цикл и запускает репарацию ДНК. Если за отведенное время повреждения устранить не удается, то клетка направляется в апоптоз. В опытах G.Selivanova и соавт. [22] мимикрия хромосомных разрывов достигалась при помощи коротких фрагментов ДНК. Активацию белка р53 наблюдали после добавления коротких одноцепочечных ДНК в клеточные экстракты, а введение в среду культивирования олигонуклеотидов явилось причиной накопления белка р53 в ядрах клеток линии МСF7. Таким образом, включение механизмов апоптоза у ранних эмбрионов в ответ на проникновение со сперматозоидом даже малых количеств фрагментированной ДНК представляется вполне вероятным и может быть одним из способов защиты развивающегося организма от чужеродной генетической информации. Приведенные факты свидетельствуют, что наряду с обнаруженной ранее способностью эякулированных сперматозоидов кролика спонтанно захватывать экзогенную ДНК [9, 10] и переносить ее во время оплодотворения в ооциты [12], существуют механизмы, препятствующие перколяции [23] чужеродной ДНК в геном. Обработка спермиев кролика ДНК в концентрации выше 0,5 мг/мл являлась причиной уменьшения подвижности сперматозоидов и резкого снижения оплодотворяемости яйцеклеток, а при 5–10 мкг/мл в ряде случаев вызывала фрагментацию и гибель эмбрионов. И.Ю. Щит, А.В. Кузнецов, С.А. Каурова, И.В. Кузнецова, В.В. Гусев Государственный научный центр прикладной микробиологии, Оболенск; Институт биофизики клетки РАН, Пущино, Московская область Литература 1. Дыбан А.П., Городецкий С.И. Трансгенные млекопитающие: изучение фенотипических эффектов гена гормона роста человека, индуцированного животным. Биотехнология 1987; 3:352—357. 2. Mark W.K., Signorelly K., Lacy E. An insertional mutant in a transgenic mouse line results in developmental arrest at day 5 of gestation. Cold Spring Harbor Symp Quant Biol 1985; 50: 453—463. 3. Гольдман И.Л., Эрнст Л.К., Гоголевский П.А., Афанасьев В.М., Семенова В.А., Гращук М.А., Коновалов М.А., Кленовицкий П.М., Живалев И. К., Полежаева И.А., Миталипова М.М., Жаданов А. Б., Кузнецов А. В., Дворянчиков Г.А., Дубовая Т.К. Исследование экспрессии гена гормона роста крупного рогатого скота у кролика, трансгенного по генной конструкции mMTI/bGHatt, содержащей MAR (Matrix Attachment Region) элемент. Доклады Россельхозакадемии 1993; 1:58—71. 4. Шан Лицзуань, Бенюмов А. О., Голиченков В.А. Аномалии эмбриогенеза у трансгенных Danio rerio (pisces). Генетика 1994; 30 (приложение): 180. 5. Jonak J., Habrova V., Takac M., Macha J., Reinis M., Pokorna H. Transfer of Rouse sarcoma virus DNA to ova by Xenopus laevis spermatozoa. Biology International 1994; 18(5): 465. 6. Horan R., Powell R., McQuaid S., Gannon F., Houghton J.A. Association of foreign DNA with porcine spermatozoa. Arch Androl 1991; 26: 83—92. 7. Кузнецова И.В., Кузнецов А.В., Сигаева В.А., Щит И.Ю. Использование сперматозоидов кролика в качестве вектора для чужеродной ДНК. Биотехнология 1993; 11, 12:2—5. 8. Zani M., Lavitrano M., French D., Lulli V., Maione B., Sperandio S., Spadafora C. The mechanism of binding of exogenous DNA to sperm cells: factors controlling the DNA uptake. Exp Cell Res 1995; 217: 57—64. 9. Кузнецов А.В., Сигаева В.А., Кузнецова И. В., Щит И.Ю. Сперматозоиды кролика способны связывать чужеродную ДНК. Пробл репрод 1996; 1: 7–10. 10. Сигаева В.А., Кузнецова И.В., Кузнецов А.В. Связывание экзогенной ДНК сперматозоидами. Пробл репрод 1996; 2: 18—20. 11. Кузнецова И.В. Использование сперматозоидов в качестве подвижного вектора для переноса чужеродной генетической информации в яйцеклетки кролика. Дисс. ... канд. биол. наук. Дубровицы 1995. 12. Кузнецов А.В., Кузнецова И.В. Связывание экзогенной ДНК pRKSlacZ сперматозоидами кролика, ее перенос в ооциты и экспрессия в доимплантационных эмбрионах. Онтогенез 1995; 26(4): 300—309. 13. Calvete J.J., Sanz L., Dostalova Z., Scheit K.-H., Sinowatz F., Amselgruber W., Topfer-Petersen E. Heparin-binding proteins on mammalian spermatozoa: biochemical characterization, cellular topography, and their fate during sperm capacitation. Cell Biol Intern 1994; 18(5): 464. 14. Sliwa L. Heparin as a chemoattractant for mouse spermatozoa. Arch Androl 1993; 31(3): 149—152. 15. Mori Т., Guo M.W., Mori E., Shindo Y., Mori N., Fukuda A., Mori T.A. Expression of class II major histocompatibility complex antigen on mouse sperm and its roles in fertilization. Am J Reprod Immunol 1990; 24: 9—14. 16. Wu G.M., Nose K., Mori E., Mori T. Binding of foreign DNA to mouse sperm mediated by its MHC class II structure. Am J Reprod Immunol 1990; 24: 120— 126. 17. Francolini M., Lavitrano M., Lamia С.L., French D., Frati L., Cotelli F., Spadafora C. Evidence for nuclear Internalization of exogenous DNA into mammalian sperm cells. Mol Reprod Dev 1993; 34: 133—139. 18. Maione В., Pittoggi С., Achene L., Lorenzini R., Spadafora C. Activation of endogenous nucleases in mature sperm cells upon interaction with exogenous DNA. DNA & Cell Biol 1997. 19. Jurisicova A., Varmuza S., Casper R.F. Programmed cell death and human embryo fragmentation. Mol Hum Reprod 1996; 2: 93—98. 20. Nelson W.G., Kastan M.B. DNA strand breaks, the DNA template alteration that triggers p53-dependent DNA damage response pathways. Mol Cell Biol 1994; 14:1815—1823. 21. Bakalkin G., Yakovieva Т., Selivanova G., Magnusson K., Szekely L., Kiseleva E., Klein G., Terenius L., Wiman K.G. p53 binding single stranded DNA ends and catalyzes DNA renaturation and strand transfer. Proc Natl Acad Sci USA 1994; 91:413—417. 22. Selivanova G., Lotsova V., Grafstrom R., Wiman K.G. DNA strand breaks: direct activators of p53. IMP 7th Spring Conference “Genes”. The Austria Center. Vienna, Austria 1996. 23. Кузнецов А.В., Жаданов А.Б., Кузнецова И.В., Щит И.Ю. Перколяция чужеродных последовательностей ДНК в геном при оплодотворении. Пробл репрод 1997. |