Особенности оплодотворения ооцитов и развития эмбрионов в культуре в зависимости от реакции яичников
|
Одним из основных условий успешного лечения бесплодия методом оплодотворения ооцитов в культуре и последующего переноса эмбрионов в полость матки (in vitro fertilization – IVF, метод экстракорпорального оплодотворения – ЭКО) является оптимальная стимуляция процессов фолликулогенеза, суперовуляции и рецептивности эндометрия [1]. Ранее было показано, что ответ яичников на стимуляцию может зависеть как от возраста женщины, так и от наличия овариальной недостаточности [2, 3].
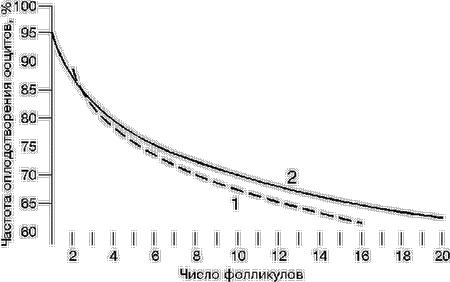
Данные литературы о влиянии ответа яичника на процессы оплодотворения и последующего развития достаточно противоречивы. По мере увеличения числа фолликулов в яичнике в ответ на стимуляцию наблюдали снижение частоты оплодотворения ооцитов [4]. В то же время другие авторы [5] (1996) отмечали повышение доли оплодотворенных ооцитов при увеличении числа пунктированных фолликулов. В настоящей работе изучена зависимость между числом пунктированных фолликулов и такими показателями, как частота оплодотворения ооцитов, формирования диплоидных и полиплоидных зигот, а также развитием эмбрионов в культуре. Материал и методы Проанализированы исходы 1146 пункций фолликулов, в результате которых были получены ооциты у женщин, проходивших ЭКО в Центре ЭКО Научно-исследовательского института акушерства и гинекологии им. Д.О. Отта РАМН. У всех больных показанием к проведению ЭКО явилось трубно-перитонеальное бесплодие вследствие непроходимости или отсутствия маточных труб. Возраст больных колебался от 19 до 46 лет и составлял в среднем 31,3±0,1 года. Для стимуляции суперовуляции использовали кломифенцитрат (клостилбегит) и человеческий менопаузальный гонадотропин (хумегон, пергонал). Для индукции овуляции вводили хорионический гонадотропин (ХГ) при достижении лидирующими фолликулами диаметра 17–18 мм. В среднем у одной женщины было пунктировано 7,83±0,13 фолликула и при этом получено 5,63±0,09 ооцита. Ооциты отмывали и культивировали в среде Ham-F10 с альбумином человека в течение 6 ч. Для инсеминации вводили 100 000 сперматозоидов в 1 мл среды. Через 18 ч определяли число пронуклеусов в зиготах, при этом полиплоиды удаляли, а нормальные зиготы переносили в свежую среду. Через 24 ч с момента начала наблюдения за зиготой эмбрионы анализировали под микроскопом и определяли число бластомеров и степень выраженности процесса фрагментации бластомеров. Выделяли три основные типа эмбрионов – эмбрионы, имеющие бластомеры без фрагментации, а также эмбрионы с легкой и тяжелой степенью фрагментации цитоплазмы. Индекс фрагментации у эмбрионов первой группы был обозначен цифрой 3, у второй – цифрой 2 и у третьей– цифрой 1. Вторая оценка эмбрионов происходила перед переносом их в полость матки через 72 ч с момента выделения ооцитов из фолликулов. Для переноса отбирали четыре эмбриона с наибольшим числом бластомеров и наименьшей степенью фрагментации цитоплазмы. В среднем при оплодотворении в культуре было получено 3,52±0,68 эмбриона в расчете на одну пункцию и перенесено в полость матки 2,72±0,03 эмбриона. Частоту оплодотворения вычисляли как отношение числа зигот к общему числу оплодотворенных клеток. Этот показатель в среднем составил 70,43±0,73%. Частоту дробления зигот определяли как отношение числа эмбрионов к общему числу полученных зигот. В среднем эта величина составила 94,38±0,41%. Частоту встречаемости полиплоидных зигот вычисляли по отношению числа полиплоидных зигот к общему числу ооцитов. Среднее значение этого показателя составило 5,11±0,32%. Для анализа полученных результатов использовали методы вариационного, дисперсионного, корреляционного и регрессионного (линейного, а также множественного) анализа. Результаты С помощью регрессионного метода проанализированы результаты 1146 пункций. Показано, что с увеличением числа пунктированных фолликулов наблюдалось достоверное снижение таких показателей, как частота оплодотворения (r=–0,21; р меньше 0,0001) и развития зигот (r=–0,12; р меньше 0,0001), и повышалась частота образования полиплоидных зигот в культуре (r=0,48; р меньше 0,0001). С использованием регрессионного анализа нами установлено, что зависимость частоты оплодотворения от числа фолликулов может быть охарактеризована кривой 1 на рис. 1 и формулой: А = 83,64 – 1,42ЅN, где А – частота оплодотворения ооцитов, %; N – число пунктированных фолликулов. Зависимость частоты оплодотворения в культуре от числа пунктированных фолликулов была изучена также в группе пациенток в возрасте от 20 до 39 лет с нормальными показателями спермограммы у мужа по результатам 759 пункций. В этой группе зависимость частоты оплодотворения от числа пунктированных фолликулов характеризуется кривой 2 на рис. 1 и формулой: А = 94,69 – 10,69 Ѕ lnN, где A – частота оплодотворения ооцитов, %, N – число пунктированных фолликулов (от 1 до 20).
1 – анализ результатов 1146 пункций; 2 – анализ результатов пункций у женщин в возрасте до 39 лет и нормальными показателями спермограммы мужа. По мере увеличения числа пунктированных фолликулов происходило закономерное снижение частоты оплодотворения в культуре (табл. 1). Таблица 1. Влияние числа пунктированных фолликулов на частоту оплодотворения ооцитов
Примечание. 1–1, 7–7 – p меньше 0,001; 2–2, 3–3, 5–5, 6–6, 9–9 – p меньше 0,01; 4–4, 8–8 – p меньше 0,05. Нами проанализирована взаимосвязь числа пунктированных фолликулов и частоты формирования полиплоидных зигот. Количественные данные, характеризующие частоту полиплоидии при различных значениях числа пунктированных фолликулов у нескольких групп пациенток, приведены в табл. 2. Максимальная частота образования полиплоидных зигот наблюдалась при пункции более 15 фолликулов. С уменьшением числа пунктированных фолликулов доля полиплоидных зигот постепенно снижалась. Таблица 2. Влияние числа пунктированных фолликулов на частоту образования полиплоидных зигот и развития диплоидных зигот
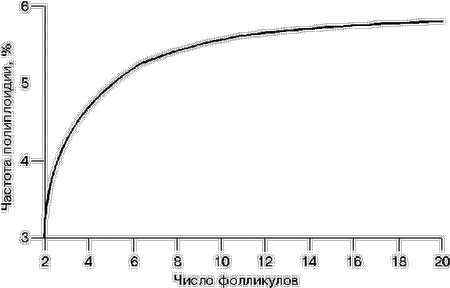
Примечание. 1–1, 7–7 – p меньше 0,001; 2–2, 3–3, 5–5, 6–6, 9–9 – p меньше 0,01; 4–4, 8–8 – p меньше 0,05. С помощью регрессионного анализа показано, что зависимость частоты полиплоидии от числа пунктированных фолликулов имеет нелинейный характер и может быть охарактеризована следующей формулой и графическим изображением (рис. 2): Р = 6,12–5,58:N , где Р – частота образования полиплоидных зигот, %; N – число пунктированных фолликулов.
При усилении ответа яичника на стимуляцию наблюдается некоторое повышение частоты блокирования развития на стадии зиготы. Максимальная (96,9%) частота развития зигот наблюдалась в группе со слабым ответом, а минимальная (90,5%) – в группе женщин с 15 фолликулами и более. Мы проанализировали влияние на развитие эмбрионов в культуре такого показателя, отражающего ответ яичника на стимуляцию, как число пунктированных фолликулов. Количественные данные, характеризующие развитие эмбрионов в зависимости от числа пунктированных фолликулов, приведены в табл. 3. При анализе всех полученных эмбрионов у женщин, у которых пунктировано от 11 до 15 фолликулов, было установлено, что число бластомеров и индекс фрагментации у них были достоверно выше (р меньше 0,05), чем в тех случаях, когда число пунктированных фолликулов составляло 5–7. Индекс фрагментации перенесенных в полость матки эмбрионов также был выше (р меньше 0,001) у женщин с числом пунктированных фолликулов от 11 до 15 по сравнению с аналогичным показателем для эмбрионов женщин с 7 фолликулами и менее. Число бластомеров у эмбрионов в группе больных с 5–7 фолликулами было также достоверно снижено (р меньше 0,001) по сравнению с эмбрионами, полученными из яичников женщин с 11 фолликулами и более. Таблица 3. Влияние числа пунктированных фолликулов на развитие эмбрионов в культуре
С помощью параметрического и непараметрического корреляционного анализа нами отмечено, что с увеличением числа фолликулов в яичнике достоверно снижается фрагментация у перенесенных эмбрионов (r= 0,12; р меньше 0,001) и повышается у них число бластомеров (r= 0,12; р меньше 0,001) через 72 ч после выделения ооцитов из фолликулов. Полученные результаты свидетельствуют о том, что по мере усиления ответа яичника на стимуляцию с помощью кломифенцитрата и менопаузального гонадотропина и увеличения числа пунктированных фолликулов, полученных ооцитов и эмбрионов происходит повышение частоты образования полиплоидных зигот, несколько снижается частота оплодотворения ооцитов. Процесс развития эмбрионов в культуре при этом улучшается, что выражается в уменьшении частоты фрагментации и повышении числа бластомеров. При слабом ответе яичника на стимуляцию, когда число пунктированных фолликулов не превышало 4, частота оплодотворения ооцитов была максимальна – в среднем 80%. Минимальное значение этого параметра наблюдалось при развитии более 15 фолликулов и составляло 62%. Таким образом, при повышении числа пунктированных фолликулов и полученных ооцитов происходит снижение доли оплодотворенных ооцитов. Обсуждение Вопросы оптимизации процессов оплодотворения и развития эмбрионов человека в культуре имеют важное практическое значение в связи с широким использованием метода ЭКО для лечения бесплодия. В теоретическом плане изучение этих вопросов необходимо для развития представлений о молекулярно-клеточных факторах, регулирующих репродукцию у человека [6, 7]. В нашей работе была исследована способность ооцитов к оплодотворению в культуре, а также к дальнейшему эмбриональному развитию после стимуляции суперовуляции кломифенцитратом и менопаузальным гонадотропином с последующей индукцией овуляции ХГ. В ряде работ [8–10] показано, что полиплоидия чаще возникает в зрелых ооцитах и ее частота коррелирует с частотой наступления беременности. Существует и противоположная точка зрения, согласно которой оплодотворение незрелых клеток приводит к образованию полиплоидных зигот [11]. Полученные нами данные свидетельствуют о том, что с увеличением числа пунктированных фолликулов при гормональной стимуляции суперовуляции происходит закономерное снижение доли оплодотворенных ооцитов, что обычно связано с незрелостью ооцитов, и при этом мы наблюдали повышение частоты формирования полиплоидных зигот. Это дает основание предположить, что причиной увеличения доли полиплоидных зигот является незрелость ооцитов. В ряде работ показано, что при увеличении числа пунктированных фолликулов наблюдается снижение качества ооцитов и частоты наступления беременности [11, 12]. В то же время в работе [10] при анализе 392 циклов ЭКО с применением агонистов гонадотропин-рилизинг-гормона отмечено отсутствие взаимосвязи ответа яичника на стимуляцию и частоты образования полиплоидных зигот. В этом же исследовании отмечена положительная корреляция между числом полученных ооцитов и долей оплодотворенных клеток. Результаты нашей работы свидетельствуют о наличии зависимости как частоты оплодотворения, так и частоты полиплоидии от числа пунктированных фолликулов при стимуляции овуляции c помощью кломифенцитрата. Следовательно, по мере усиления ответа яичников на гормональную стимуляцию происходит закономерное увеличение гетерогенности полученных ооцитов, что отражается в снижении частоты оплодотворения в культуре и повышении частоты формирования полиплоидных зигот. Целесообразно проведение дальнейших исследований для решения вопроса о влиянии различных схем стимуляции яичников на процессы оплодотворения и формирования полиплоидных зигот в культуре. Данные литературы о факторах, влияющих на процесс развития эмбрионов человека в культуре, немногочисленны. Показано влияние гормональной недостаточности яичников на преимплантационное развитие эмбрионов животных [13] и человека [14] в культуре. В работе [14] выявлены различия в темпах развития, выраженности процесса фрагментации, особенностях метаболизма и в числе клеток на стадии бластоцист у эмбрионов женщин с разными формами гормональной недостаточности яичников, а также при применении нескольких различающихся схем гормональной стимуляции яичника. При анализе результатов 770 циклов ЭКО было показано, что фрагментация эмбрионов чаще наблюдалась у женщин с пониженным перед введением ХГ уровнем эстрадиола, с длительным периодом бесплодия, при увеличении дозы вводимых гормонов, а также при повышении числа пунктированных фолликулов [15]. В более ранних работах отмечено, что при понижении уровня эстрадиола в крови в 1-й день после введения ХГ наблюдается ухудшение морфологических характеристик эмбрионов [16, 17]. Отмечено повышение частоты образования эмбрионов без фрагментации в группе больных с сильной реакцией яичника (более 10 пунктированных фолликулов) на стимуляцию с использованием схем стимуляции с агонистами гонадотропин-рилизинг-гормона [18]. Наши данные о влиянии ответа яичника при использовании стимуляции с применением кломифенцитрата на развитие эмбрионов человека дополняют результаты этих исследований. При стимуляции яичников с использованием кломифенцитрата оптимальное развитие эмбрионов в культуре наблюдается при наличии в яичниках более 11 фолликулов. Полученные нами результаты свидетельствуют о том, что по мере усиления ответа яичника на стимуляцию с помощью кломифенцитрата и менопаузального гонадотропина и увеличения числа пунктированных фолликулов, полученных ооцитов и эмбрионов происходит повышение частоты образования полиплоидных зигот; несколько снижается частота оплодотворения ооцитов, процесс развития эмбрионов в культуре при этом улучшается, что выражается в уменьшении частоты фрагментации и повышении числа бластомеров. При слабом ответе яичника на стимуляцию, когда число пунктированных фолликулов не превышало 4, частота оплодотворения ооцитов была максимальна и составляла в среднем 80%. Минимальное значение этого параметра наблюдалось при развитии более 15 фолликулов и составляло 62%. Таким образом, при повышении числа пунктированных фолликулов и полученных ооцитов происходит снижение доли оплодотворенных ооцитов. Результаты, полученные в настоящей работе, показывают, что такие клеточные процессы, как формирование полиплоидных зигот и частота оплодотворения ооцитов, зависят от реакции яичников на стимуляцию суперовуляции. В данной модельной системе удается выявить влияние характера фолликулогенеза на морфологические характеристики преимплантационных эмбрионов человека. О.А. Воробьева, В.В. Потин, В.С. Корсак, А.А. Кирсанов, В.В. Козлов Международный центр репродуктивной медицины, НИИ акушерства и гинекологии им. Д.О. Отта РАМН, Санкт-Петербург; Чикагский институт репродуктивной генетики Литература 1. Корсак B.C., Исакова Э.В., Воробьева О.А., Каменецкий Б.А., Кирсанов А.А. Применение золадекса (госерелина) в схеме индукции суперовуляции в программе ЭКО. Пробл репрод 1996; 3: 23–27. 2. Кирсанов А.А., Корсак B.C., Полянин А.А. Ответ яичника на гонадотропную стимуляцию в программе ЭКО у пациенток различных возрастных групп. Материалы 23 научной сессии НИИ акушерства и гинекологии. 1994; 105. „ 3. Кирсанов А.А. Реакция яичников на стимуляцию суперовуляции у женщин с трубно-перитонеальным бесплодием. Автореф. дисс. ... канд. мед.наук, Санкт-Петербург 1997; 21. 4. Olivennes F., Aymar С., Bomsel-Helmreich O., Frydman R. Oocyte quality and collection: assessment of oocyte quality in an IVF program. Assist Reprod Rev 1993; 3: 218–223. 5. Magli M.C., Gianaroli L., Fiorentino A., Ferraretti A.P., Fortini D., Pannzella S. Improved cleavage rate of human embryos cultured in antibiotic-free medium. Hum Reprod 1996; 11: 7: 1520–1523. 6. Воробьева О.А., Никитин А.И., Потин В.В., Свечникова Ф.А. Перспективы изучения нормогонадотропной ановуляции. Тезисы докладов 19 научной сессии, посвященной памяти проф. Д.О. Отта. Л 1990; 30. 7. Потин В.В., Воробьева О.А. Современные представления о роли факторов роста в системе внутритканевых регуляторов репродукции. Пробл эндокрин 1993; 39: 58–62. 8. Rudak D., Dov J., Mashiach S., Nebel L., Goldman B. Chromosome analysis of multipronuclear human oocytes fertilization in vitro. Fertil Steril 1984; 41: 538–548. 9. Herman H., Caspi E. Increased fertilization and pregnancy rate in polypronuclear cycles in in vitro fertilization-embryo transfer. Fertil Steril 1992; 57: 139–142. 10. Yie S.-M., Collins J.A., Daya S., Hughes E., Sagle M. et al. Polyploidy and failed fertilization in in-vitro fertilization are related to patient’s age and gamete quality. Hum Reprod 1996; 11: 3: 614–617. 11. Van Der Ven H.H., Al-Hasani S., Diedrick K. et al. Polyspermy in in vitro fertilization of human oocytes: frequency and possible causes. Ann N Y Acad Sci 1982; 442: 88–95. 12. Toner J.P., Brzyski R.G., Oehninger S. et al. Combined impact of number of pre-ovalatory oocytes and cryopreservation on IVF outcome. Hum Reprod 1991; 6: 284–289. 13. Eppig J.J., Schroeder A.C., O’Brien M.J. Development capacity of mouse oocytes matured in vitro: effects of gonadotrophin stimulation, follicular origin and oocyte size. J Reprod Fertil 1992; 95: 119–127. 14. Hardy К., Robinson P.M., Paraschos T., Wicks R., Franks S., Winston R.M.L. Normal development and metabolic activity of preimplantation embryos in vitro from patients with polycystic ovaries. Hum Reprod 1995; 10: 7: 2125–2135. 15. Devreker F., Pogonici E., Biramane J., Vanin A.-S., Van den Bergh M., Englert Y. Factors influencing embryo morphology. Hum Reprod 1997, Abst. Book 1, v. 12, june 22–25, 13th Annual Meeting, Edinburg, European Society of Hum Reprod and Embryol. 16. Dor J., Rudak E., Mashiach S., Nebel L., Serr D.M., Lordman B. Periovulatory 17b-estradiol changes and embryo morphologic features in conception and nonconception cycles after human in vitro fertilization. Fertil Steril 1986; 45: 63–68. 17. Shulman A., Ben-Nun I., Jhetles Y., Kaneti H., Shilon M., Beyth Y. Relationship between embryo morphology and implantation rate after in vitro fertilization treatment in conception cycles. Fertil Steril 1993; 60: 1: 123–126. 18. Fanchin R., Righini C., Olivennes F., Ferrera A.L., Ziegler D., Ftydman R. Consequences of premature progesterone elevation on the outcome of in vitro fertilization: insighs into a controversy. Fertil Steril 1997; 68: 5: 799–805. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||