Клинико-лучевые и гормональные параллели у женщин репродуктивного возраста
|
"Неактивные" аденомы гипофиза (НАГ) - доброкачественные новообразования, составляющие, по данным ряда авторов, 25-30% всех опухолей гипофиза [1]. Диагностика НАГ является сложной задачей, поскольку в течении заболевания отсутствуют характерные клинические симптомы или синдромы (синдром Иценко-Кушинга, акромегалия, синдром галактореи-аменореи и др.). В гормональном статусе таких больных редко выявляются выраженные изменения.
Дифференциальная диагностика при помощи визуализирующих методов "гормонально-неактивных" аденом затруднена и требует отличительного распознавания от гиперплазии, атрофии и дистрофии гипофиза. К сожалению, редко представляется возможным произвести морфологическое изучение ткани аденомы. Использование пункционной биопсии представляет собой значительные трудности, поскольку риск развития необратимых осложнений в ответ на хирургическое вмешательство весьма велик. Это объясняет ведущую роль в диагностике НАГ неинвазивных методов, среди которых заметная роль принадлежит визуализирующим методам (краниографии, компьютерной томографии - КТ, магнитно-резонансной томографии - МРТ), а также гормональным исследованиям с проведением соответствующих функциональных тестов. У женщин НАГ нередко сочетаются с патологией репродуктивной системы. Исследования, касавшиеся НАГ больших размеров (более 1 см в диаметре), показали, что в 88% такие аденомы сочетаются с синдромом поликистозных яичников (СПKЯ), у 23% женщин имеется вторичная аменорея, а у ряда больных выявлен гипогонадизм [2]. У больных с нарушениями репродуктивной системы НАГ малых размеров (менее 1 см в диаметре) выявляются обычно как находка при детальном обследовании. При наблюдении и лечении таких больных практические врачи могут испытывать определенные трудности, так как до конца не ясно, как могут повлиять медикаментозные препараты, применяемые для лечения той или иной гинекологической патологии, на НАГ. До сих пор остается открытым вопрос: влияет ли НАГ на репродуктивную систему женщин, поскольку несмотря на отсутствие клинической и гормональной активности, эти аденомы могут секретировать незначительные количества гормонов [1]. Не изучено и воздействие патологических состояний репродуктивной системы на НАГ. В настоящей статье мы представили данные, позволяющие пролить свет на эти и некоторые другие вопросы. Материал и методы В гинекологическом отделении Эндокринологического научного центра (ЭНЦ) РАМН тщательному обследованию подверглись 87 женщин, поступивших с предварительным диагнозом микроаденомы гипофиза и предъявлявших жалобы на нарушения со стороны репродуктивной системы в период с 1985 по 1999 г. Средний возраст больных, включенных в исследование, составил 24,96±6,38 года (15-41 год). Всем больным проводилось обследование по следующему алгоритму: общий и гинекологический осмотр, лучевые и визуализирующие исследования с обязательным проведением краниографии, КТ или МРТ с контрастированием, дополнявшиеся впоследствии гормональными исследованиями. Для проведения методики "усиления" изображения использовались различные контрастные вещества (верографин, урографин и др. при КТ и магневист, гадолиниум при МРТ). В качестве контрольной группы были обследованы женщины с неподтвердившимся диагнозом НАГ и нарушениями со стороны репродуктивной системы. При оценке результатов гормональных нагрузочных проб контролем явились практически здоровые женщины репродуктивного возраста (n=7), которым предварительно проводилось клинико-гинекологическое исследование, определение исходного гормонального статуса, обзорная рентгенография черепа и ультразвуковое исследование (УЗИ) органов малого таза. Исследование гормонального статуса включало определение базальных концентраций тропных гормонов гипофиза в сыворотке крови при помощи реометодов в соответствии с системой ВОЗ - иммунологически активных лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), пролактина (ПРЛ) и по показаниям - тиреотропного гормона (ТТГ) и соматотропного гормона (СТГ). Содержание свободной АС в сыворотке крови определяли радиоиммунологическим методом с использованием тест-систем, разработанных в Институте экспериментальной эндокринологии ЭНЦ РАМН на основе высокоочищенных антигенов и моноспецифических поликлональных антисывороток. В качестве рабочих стандартов при этом применяли препараты гормонов высокой степени очистки, аттестованные по международным стандартам ВОЗ. Для исследования функции яичников и надпочечников при помощи реометодов в соответствии с системой ВОЗ в сыворотке крови определяли тестостерон, 17-гидроксипрогестерон, ДГЭА-сульфат и эстрадиол. Оценивалась реакция тропных гормонов гипофиза (ПРЛ, ТТГ, ЛГ и ФСГ) при проведении фармакодинамических проб (с метаклопрамидом - церукалом фирмы ADG, тиролиберином - протирелином фирмы "Ферринг", агонистом люлиберина - супрефактом фирмы "Хёхст Марион Руссель", Германия). Все пробы проводились на 5-7-й день менструального цикла (или на фоне аменореи). Церукал 10 мг (2 мл) или тиролиберин (0,2 мг) вводили внутривенно струйно, кровь из вены брали до введения препарата и через 15, 30, 60, 90 и 120 мин после его введения. Супрефакт (бусерелина ацетат) вводился в дозе 500 мкг подкожно, в область передней брюшной стенки, параумбиликально. При этом взятие крови проводилось до и через 1, 6 и 24 ч после введения препарата. Каждая проба проводилась с интервалом один менструальный цикл или через месяц при аменорее. В ходе проведения проб побочных реакций у пациенток не выявлено. Состояние репродуктивной системы оценивалось по данным анамнеза, гинекологического осмотра и УЗИ. Овуляторная функция динамически исследовалась по базальной температурной кривой и тестам функциональной диагностики. Полученные данные обрабатывались при помощи программы "Exel-7,0", показатель достоверности результатов р рассчитывался на основе критерия Стьюдента (для количественных показателей) и c2-теста (для качественных показателей). Статистически достоверными считались различия при р меньше 0,05. Результаты и обсуждение Лучевая диагностика. Изучение результатов лучевых методов исследования (краниографии, КТ и МРТ с использованием методики "усиления") и сопоставление их с данными гормональных методов исследования позволило нам правильно поставить диагноз и выбрать рациональную тактику дальнейшего ведения больных. Показаниями к проведению КТ (или МРТ) с методикой "усиления" являлись следующие рентгенологические симптомы развития опухоли на краниограммах: 1) локальное истончение или остеопороз стенок турецкого седла; 2) тотальное истончение или остеопороз стенок турецкого седла; 3) неровность участка внутреннего контура костной стенки турецкого седла; 4) увеличение размеров турецкого седла. Анализ показал, что при оценке результатов краниографии, КТ и МРТ имели место случаи как гипер-, так и гиподиагностики микроаденом гипофиза. Гиподиагностика микроаденом гипофиза у 2 больных была связана с игнорированием вышеуказанных симптомов при проведении краниографии. Из 87 обследованных больных у 48 (55,17%) женщин выявлены НАГ. У 7 (8,05%) женщин после дополнительных (в том числе гормональных) исследований обнаружены микропролактиномы гипофиза. Неопухолевые процессы, симулировавшие аденомы гипофиза (такие, как обызвествление твердой мозговой оболочки, повышение внутричерепного давления (ВЧД), синдром "пустого" турецкого седла и др.) диагностированы у 32 (36,78%) женщин (табл. 1). Таблица 1. Неопухолевые процессы в области турецкого седла (n=32)
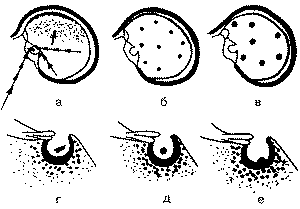
Эндокраниоз, или обызвествление твердой мозговой оболочки (рис. 1) явился самым распространенным патологическим процессом и нередко приводит к гипердиагностике аденом гипофиза.
Рис. 1. Схематическое изображение обызвествлений различного происхождения в черепе, симулирующих на краниограммах аденомы гипофиза. а - обызвествления при эндокраниозе: * - в лобном отделе, ** - позади спинки седла, *** - диафрагмы седла, **** - параселларно; б - при туберкулезном менингите; в - при токсоплазмозе; г - в стенках сосудов; д - в гематомах гипофиза; е - остеома спинки седла. Повышение ВЧД может приводить к небольшому увеличению размеров турецкого седла, расширению входа в него. В этих случаях для разрешения диагностической задачи необходимы КТ или МРТ с контрастированием. Варианты патологических изменений гипофиза при КТ и МРТ представлены на рис. 2 и 3.
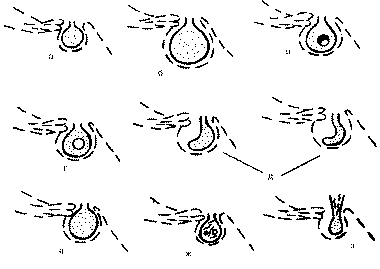
Рис. 2. Схематическое изображение состояния гипофиза на компьютерной томограмме в норме и при различных патологических процессах. а - неизмененный гипофиз; б - макроаденома гипофиза; в - микроаденома гипофиза (монофокусная форма); г - микроаденома гипофиза (мультифокусная форма); д - аденома гипофиза с кистозным компонентом; е - киста гипофиза; ж - обызвествление твердой мозговой оболочки, симулирующее микроаденому гипофиза; з - "пустое" турецкое седло.
Рис. 3. Схематическое изображение состояния гипофиза на МРТ-грамме в норме и при различных патологических процессах. а - неизмененный гипофиз; б - макроаденома гипофиза; в - аденома гипофиза с кистозным компонентом; г - киста гипофиза; д - варианты "пустого" турецкого седла; е - гиперплазия гипофиза или гипофизит; ж - дистрофические изменения гипофиза, кистозное перерождение; з - утолщенный стебель и атрофия гипофиза. В нашем исследовании у всех женщин аденомы гипофиза имели размеры, не превышающие 1 см в диаметре (микроаденомы). Минимальная величина микроаденом гипофиза при КТ составляла 3 мм, при МРТ - 2 мм - у 9 (18,75%) больных. Наиболее часто - у 23 (47,9%) больных встречались микроаденомы размером 5-7 мм, у 6 (12,5%) больных их размер составлял 8-10 мм. Структура НАГ (по данным лучевой диагностики) была однородной у всех больных, кроме двух, у которых имелись кистозные аденомы с наличием просветления в центре. У всех больных микроаденомы были округлой или овоидной формы. Таким образом, всем пациенткам с патологией репродуктивной системы показано проведение краниографии, а при подозрении на аденому гипофиза - КТ или МРТ гипофиза. Клиническая картина. Все обследованные больные были разделены на две группы. В 1-й группе наблюдалось 48 женщин с подтвержденным диагнозом НАГ, во 2-й группе - 32 женщины с неподтвердившимся диагнозом НАГ. В отдельную группу выделены 7 больных, у которых после детального обследования выявлена микропролактинома. Подробно структура патологии в обеих группах представлена в табл. 2. Таблица 2. Структура патологии репродуктивной системы
* Данный патологический процесс представлен здесь в связи с необходимостью проведения отличительного распознавания от СПКЯ или СТЯ, что нередко вызывает диагностические трудности. Большинство среди больных с патологией репродуктивной системы в обеих группах составили женщины с СПКЯ (или СТЯ) в 1-й группе - 44 (89,8%, n=48), во 2-й группе - 24 (75%, n=32). Это может свидетельствовать о существовании патогенетической взаимосвязи СПКЯ и патологических процессов в гипофизе, в том числе аденомы гипофиза. При изучении анамнеза больных мы обращали внимание на особенности препубертатного и пубертатного периода обследуемых женщин (табл. 3). Таблица 3. Анамнестические данные больных
* Средний возраст менархе у здоровых женщин, по данным [3], составляет 12,9 года. Развитие гирсутизма происходило до менархе или в ближайшее время после него, а возраст первых его проявлений достоверно не различался в 1-й и 2-й группах (р больше 0,05). Возраст менархе в обеих группах был близок к таковому в здоровой популяции. Часто в анамнезе имелись указания на перенесенную вирусную инфекцию (эпидемический паротит, ветряная оспа, грипп и др.) в 1-й группе, что, возможно, оказывало влияние на становление гипоталамо-гипофизарной функции, а также могло вызывать непосредственное повреждение ткани эндокринных желез. Клиническая картина у рассматриваемых групп больных представлена в табл. 4. Наиболее частыми клиническими проявлениями в обеих группах являлись: бесплодие, гирсутизм, аменорея. Таблица 4. Клиническая характеристика больных
* Бесплодием, в соответствии с международными критериями, считается ненаступление беременности у женщины, имеющей регулярную половую жизнь без предохранения в течение года и более. В гинекологическом статусе больных как 1-й, так и 2-й групп преобладали симптомы вирилизации (гирсутизм, увеличение клитора, вульгарные акне, реже - алопеция). При бимануальном исследовании определялась гипоплазия матки у 25 (61,9%) больных 1-й группы и у 15 (65,2%) больных 2-й группы (р больше 0,05), увеличенные безболезненные яичники пальпировались - соответственно у 38 (92,9% и у 20 (87%) больных (p больше 0,05). При неувеличенных размерах яичников у остальных больных диагноз СПКЯ был окончательно установлен на основании макроскопической оценки яичников в ходе операции и гистологического исследования ткани яичников. Данные гинекологического осмотра подтверждались результатами УЗИ, при котором средний объем яичников, вычисляемый по формуле эллипса (V=(p6ґL1ґL2ґL3), достоверно не различался в обеих группах (р больше 0,05). Данные объемов яичников представлены в табл. 5. Таблица 5. Величина яичников (в куб.см) в представленных группах больных
Как было отмечено выше, НАГ возможно оказывает непосредственное влияние на состояние репродуктивной системы. Однако существует и обратная взаимосвязь яичники - гипофиз, что также может воздействовать на состояние аденомы. Из литературы [3] известно, что существует повышенный риск развития не только рака эндометрия и молочных желез, но и аденом гипофиза у больных с синдромом хронической ановуляции (что наблюдается при СПКЯ). Последняя сопровождается повышением уровня эстрогенов, хроническим дефицитом прогестерона и изменением функционального состояния системы гипоталамус-гипофиз-яичники. Нами рассматривалось сочетание СПКЯ с гиперпластическими процессами репродуктивной системы у женщин 1-й и 2-й групп (табл. 6). Случаи гиперпластических процессов в эндометрии встречались достоверно чаще (р=0,044) у больных с НАГ. Таблица 6. Гиперпластические процессы при СПКЯ у рассматриваемых групп больных
Избыток жировой ткани у тучных больных может быть дополнительным источником экстрагонадного превращения андрогенов в эстрогены и являться фактором, способствующим развитию гиперпластических процессов в органах-мишенях, их персистенции или рецидивирования. Уменьшение уровня гиперэстрогении вследствие снижения массы тела может являться прогностически благоприятным фактором в отношении роста НАГ. Таким образом, имеющаяся у больных гиперэстрогения повышает риск развития гиперпластических процессов в матке и молочных железах и нередко сопутствует НАГ. Возможно, экстрагонадный пул эстрогенов в определенных случаях может являться дополнительным стимулятором роста аденом гипофиза, имеющих рецепторы к эстрадиолу. Вопрос о возможной более высокой частоте встречаемости НАГ у больных ожирением пока остается неизученным. Гормональные исследования. Изучение гормонального статуса способствовало выявлению активности аденом гипофиза и являлось обязательным этапом диагностического поиска. При этом немаловажным оказались исследования с проведением фармакодинамических функциональных проб. Базальные концентрации сывороточных гормонов у больных двух изучаемых групп представлены в табл. 7. Таблица 7. Базальный уровень гормонов у обследуемых больных
В обеих группах больных базальные концентрации гонадотропных гормонов гипофиза в сыворотке крови достоверно не различались (р больше 0,05) и соотношение ЛГ/ФСГ при этом было больше 2, что является характерным для СПКЯ [4]. Несколько повышенный уровень ЛГ и/или ФСГ при НАГ далеко не всегда указывает на повышение активности клеток аденомы гипофиза и, возможно, свидетельствует о нарушенном (напряженном) синтезе в клетках гипофиза при наличии сопутствующей эндокринной патологии (например, СПКЯ). Можно предположить нарушение ритма и/или амплитуды секреции гонадотропинов и их субъединиц, что приводит к их монотонному нециклическому выбросу гонадотропинов. Нами отмечены случаи, когда существовали определенные трудности в трактовке изменений у больных с повышенным уровнем сывороточных гонадотропинов. Только системный анализ совокупных данных обследования позволял максимально верно установить клинический диагноз. У 11 (26,8%) больных с НАГ в сочетании с СПКЯ имелась гиперпролактинемия, которая носила функциональный характер, что подтверждено проведением фармакодинамических проб с метаклопрамидом и/или тиролиберином. Как считают некоторые авторы [3], в подобных случаях СПКЯ необходимо дифференцировать от функционального состояния яичников, сопровождающего гиперпролактинемию. Как видно из табл. 7, уровень тестостерона и 17-оксипрогестерона в сыворотке крови в обеих группах превышал верхние границы нормы и достоверно не различался (р больше 0,05). Уровень эстрадиола был выше в 1-й группе, но различия не достоверны (р больше 0,05). Исследование пролактотропной функции гипофиза. Проба с метаклопрамидом. При проведении пробы с метаклопрамидом больные с НАГ и СПКЯ были разделены на две подгруппы: первая - с нормальным базальным уровнем сывороточного ПРЛ (среднее значение 330,3±63,4 мЕД/л) и с повышенным уровнем ПРЛ (911,3±117,3 мЕД/л) при трехкратном его определении (26,8% больных). Максимальный прирост уровня ПРЛ происходил на 15-й минуте (у 92,2% больных) и в среднем превышал исходный уровень в 2,5-15,2 раза (в среднем 1520%) у больных этой группы с нормальным уровнем ПРЛ и в 1,7-6,98 раза (в среднем 492%) при повышенном уровне последнего. Таким образом, отмечалось снижение реакции ПРЛ на введение метаклопрамида у больных с НАГ при умеренном повышении базального уровня данного гормона. Это может указывать на функциональный характер гиперпролактинемии в данных случаях и свидетельствовать о нарушении резервных возможностей пролактотрофов [5]. Вышесказанное подтверждает данные исследований, проведенных ранее в условиях in vitro о рефлекторной секреции повышенного количества ПРЛ нормальными лактотрофами [1]. У больных с пролактиномами (n=7) исходный уровень был достоверно выше, чем в 1-й и 2-й группах, и составил в среднем 2357,5±583,5 мЕД/мл, при этом на пробе отмечался низкий ответ (рефрактерность) к метаклопрамиду, а повышение в среднем в 1,27 раза превышало исходный уровень. У контрольной группы пациенток повышение уровня ПРЛ превышало в среднем в 6,4 раза исходный уровень. При оценке результатов пробы с тиролиберином ответная реакция ПРЛ была резко снижена при пролактиномах гипофиза (повышение в среднем в 1,19 раза от базального уровня), а при НАГ наблюдалось повышение в среднем в 4,3 раза (от 2,65 до 6,5 раза). Вышеуказанная резистентность пролактотрофов (характерная для пролактином гипофиза) свидетельствует об опухолевом генезе гиперпролактинемии [5]. Исследование гонадотропной функции гипофиза. Проба с агонистом ЛГ-РГ (супрефакт). Известно, что агонисты ЛГ-РГ нередко применяются в гинекологической практике. Вопрос о влиянии агонистов ЛГ-РГ на НАГ давно интересует исследователей и практических врачей. Ранее высказывалось предположение, что эти препараты могут вызвать рост аденомы, поскольку первая фаза их воздействия связана со стимуляцией синтеза и секреции ЛГ и ФСГ в гонадотрофах гипофиза. Однако ряд последних исследований показали, что эти препараты не только не влияют на рост аденомы [6], но и в некоторых случаях при фоническом введении могут вызывать уменьшение ее в размерах [7]. Фоновый уровень сывороточных гормонов определялся нами дважды и более. Фармакодинамическая проба с бусерелином позволила оценить резервы и изменения реакции гонадотрофов гипофиза и выяснить, нарушается ли у женщин с НАГ гонадотропная функция гипофиза. Средние значения базальных концентраций a-субъединицы (АС) гликопротеиновых гормонов у больных сравниваемых групп составили соответственно 2,20±1,0 и 0,91±0,11 в 1-й и 2-й группах (р больше 0,05) и 1,27±0,34 в контрольной. Базальная концентрация ЛГ, ФСГ и АС у больных сравниваемых групп достоверно не различалась (р больше 0,05). Отмечено, что у 8 (44,4%) больных с НАГ (n=18; 1-я группа) уровень свободной АС был достоверно выше (среднее значение 3,11±1,40 нг/мл, р=0,05) такового у больных той же группы с нормальным уровнем АС, а также женщин контрольной группы. Вышесказанное согласуется с данными литературы о наличии у 40-60% больных НАГ повышенного базального уровня свободной АС гликопротеиновых гормонов крови [1, 8]. По-видимому, это связано с нарушением ритма секреции АС в гипофизе, а также амплитуды ее выброса, что характерно для женщин с гиперандрогенной ановуляцией [9] или с повышенной секрецией АС тканью аденомы. При оценке результатов пробы с бусерелином нами не выявлено каких-либо достоверных различий в уровнях стимулированных гонадотропинов у больных исследуемых групп. При исследовании гормональной секреторной активности НАГ в ранее проведенных нами исследованиях (А.А. Булатов и соавт.) ткани НАГ, взятых у больных (из операционного материала НИИ нейрохирургии им. акад. Н. Н. Бурденко), у которых до операции содержание гипофизарных гормонов в сыворотке крови было в пределах нормы, отмечено, что культивированные in vitro клетки в клеточной культуре способны высвобождать в среду в небольшом количестве несколько гормонов, в том числе ЛГ, ФСГ, АС гликопротеиновых гормонов, а также ПРЛ и гормон роста. Мультигормональная секреторная активность таких аденом, по-видимому, недостаточна для проявления клинико-биохимической активности этих опухолей in vivo. Выводы
А.А. Булатов, А.И. Бухман, Н.П. Гончаров, А.Д. Добрачева, А.А. Пищулин, В.Г. Шлыкова, И.С. Яровая Эндокринологический научный центр (дир. - акад. РАМН И.И. Дедов) РАМН, Москва Литература 1. Katznelson U., Alexander J. M., Klibanski A. Clinical review 45 clinically nonfunctioning pituitary adenomas. J Clin Endocrinol Metab 1993; 76: 1089-1094. 2. Вакс В.В. Клинические особенности и гипоталамо-гипофизарные взаимоотношения при "неактивных" аденомах гипофиза: Дисс. ... канд. мед. наук. М 1994. 3. Yen S.S.C., Jaffe R.B. in Reproductive endocrinology 1995; 612-691. 4. Ehrmann D.A., Barnes R.B., Rosenfield R.L. Polycystic ovary syndrome as a form of functional ovarian hypeandrogenism due to dysregulation of androgen secretion. Endocr Rew 1995; 16: 322. 5. Дедов И.И., Мельниченко Г.А. в кн.: Алгоритмы диагностики и лечения болезней эндокринной системы. М 1995; 5-15. 6. Liuzzi A. Cliniсally inactive pituitary tumors. Congress of young endocrinol. 1997; suppl. 1 to no. 2: 99-100. 7. Кушель Ю.В. Гормонально-неактивные аденомы гипофиза. Пробл эндокринол 1993; 4: 59-62. 8. Katznelson L., Alexander J.M., Bikkal H.A. et al. Imbalanced follicle-stimulating hormone beta-subnit hormone biosynthesis in human pituitary adenomas. J Clin Endocrinol Metab 1992; 74: 1343-1351. 9. Berga S.L., Guzick D.S., Winters S.J. Increased Luteinizing Hormone and a-Subnit Secretion in Women with Hyperandrogenic Anovulation. J Clin Endocrinol Metab 1993; 77: 895-901. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||