Фитоэстрогены (лекция)
|
Чем настойчивее человек пытается определить свое истинное место в природе, тем яснее становится жесткая зависимость его от окружающей среды. В настоящее время под средовыми чаще всего подразумевают антропогенные (техногенные) воздействия. В то же время такие важные составляющие экосистем, как растительный и животный мир, являясь для человека источником пищи, постоянно поставляет в организм биологически активные соединения, действие многих из которых еще не оценено в полной мере. Расхожая же фраза – “экологически чистый продукт” вводит в заблуждение неспециалистов и упрощает до примитивных представления о характере и спектре действия биологически активных соединений растительного происхождения. Это заставляет уделить специальное внимание данной проблеме.
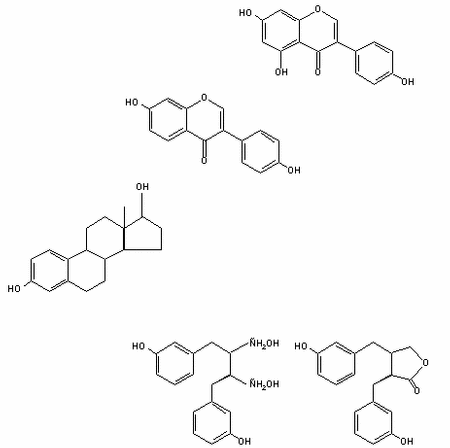
В настоящее время особый интерес вызывают некоторые представители класса биофлавоноидов, проявляющие, как показали специальные исследования, гормоноподобные, а именно – эстрогенные свойства и названные поэтому фитоэстрогенами. Хотя высокая биологическая активность лекарственных средств из растений, применяемых в том числе и для коррекции расстройств полового цикла и репродуктивной функции, известна давно, изучение роли фитоэстрогенов в физиологии и патологии репродуктивной системы человека и животных является новой, еще только начатой главой репродуктологии. Фитоэстрогены содержатся в растениях и грибах в чистом виде или в качестве предшественников соединений с эстрогенной активностью. Установлено [3, 9], что их физиологическое значение для самих растений заключается в регуляции процессов роста и размножения, защите растений от вредного действия ультрафиолетового излучения и поражения грибами и другими паразитами, контроле действия других биологически активных соединений и т.п. Многие из веществ этого класса обладают также антивирусным и бактерицидным свойствами. После открытия фитоэстрогенов и проведения начиная с середины 30-х годов исследования их структуры и биологического действия все они были разделены на 2 большие группы: изофлавоноиды, соответствующие по структуре гетероциклическим фенолам, и лигнаны, структурно относящиеся к классу дифенолов. Некоторые авторы выделяют в отдельную группу так называемые куместаны, другие относят их к изофлавоноидам. Присутствие и концентрация фитоэстрогенов в биологических субстратах определяются методами газовой хроматографии – масс-спектрометрии. Изофлавоноиды (и куместаны) представляют собой производные гликозидов и содержатся в больших количествах в соевых бобах (до 300 мг/100 г), других стручковых растениях, чечевице, гранатах, финиках, семенах подсолнечника, капусте, красном клевере и т.п. В кишечнике изофлавоноиды подвергаются гидролизу и дальнейшему метаболизму, в результате чего образуются соединения с эстрогенной активностью: формононетин, дейдзеин, генистейн, биоканин-А и др. Биоканин может метаболизироваться до генистейна, а формононетин – до дейдзеина и эквола, обладающих наибольшей эстрогенной активностью [31]. Основным представителем куместанов является куместрол. При введении в организм антибиотиков процесс образования гормонально активных фитоэстрогенов из предшественников затормаживается или прекращается. Наиболее изученные лигнаны – энтеродиол и энтеролактон являются продуктами осуществляющегося под воздействием микробов кишечника метаболизма их предшественников – секоизоларицирезинола и метайрезинола, находящихся преимущественно в наружном слое зерен, особенно пшеницы, ржи и риса, пищевых растительных волокнах, семенах льна, орехах, в некоторых ягодах, фруктах (вишне, яблоках) и овощах (чесноке, петрушке, моркови и др.). Энтеродиол может окисляться в кишечнике до энтеролактона. Последний – наиболее часто встречающийся в организме фитоэстроген млекопитающих Из некоторых плесневых грибов, в том числе поражающих растения, употребляемые в пищу животными и человеком, выделена дополнительная группа соединений, обладающих эстрогенными свойствами, например зирэлинон [10] и др., которые также отнесли к фитоэстрогенам (микоэстрогенам). В организме животных и людей фитоэстрогены впервые обнаружены в конце 60-х годов. Сначала из мочи обезьян были выделены лигнаны энтеролактон и энтеродиол, затем из мочи людей – метайрезинол и ларицирезинол, а также фитоэстрогены типа изофлавоноидов: формононетин, метилэквол, диметилангиолензин, дигидрооксиизофлован и др. Большинство из названных соединений были обнаружены также в коровьем молоке [50]. Биохимический анализ показал, что фитоэстрогены по структуре обладают определенным сходством с эндогенными эстрогенами животных (см. рисунок) и имеют близкую с ними молекулярную массу. Указанные свойства позволяют им “узнавать” эстрогенные рецепторы и связываться с ними. Это было доказано в опытах in vitro на примере лигнанов энтеролактона и энтеродиола, которые активно реагировали с эстрогенными рецепторами цитозоля матки овец и крыс [16, 49] и рецепторами к эстрогенам клеток рака молочной железы человека [35], что позволило рассматривать фитоэстрогены в качестве соединений, обладающих способностью мимикрировать или блокировать действие эндогенных эстрогенов. Характер действия фитоэстрогенов в этих случаях зависит от их способности не только быть подходящим к “замку-рецептору” “ключом”, но и способностью “ключа” “открывать замок”, стимулируя в клетке специфический синтез. В последнем случае фитоэстрогены проявляют эстрогенные свойства. При отсутствии такой способности фитоэстрогены могут выступать в качестве антиэстрогенных агентов. Следовательно, фитоэстрогены обладают потенциальной способностью модифицировать механизмы, регулирующие половой цикл и репродуктивный процесс у человека и животных.
Как выяснилось, биологическая активность фитоэстрогенов в сотни и тысячи раз ниже активности эндогенных эстрогенов, однако постоянное потребление человеком растительной пищи, а также таких продуктов, как молоко и мясо травоядных животных, может приводить к значительной концентрации фитоэстрогенов в организме. Так, в сперме человека и быка, слюне, грудном молоке, жидкости овариальных кист, соке предстательной железы лигнаны энтеролактон и энтеродиол обнаружены в количествах, превышающих концентрацию эндогенных эстрогенов до 5000 раз [21]. Наиболее яркие примеры влияния гормоноподобных соединений растительного происхождения на репродуктивную функцию сначала стали известны из ветеринарной практики. В 1946 г. у овец Австралии, выпас которых производился на пастбищах, богатых клевером вида Trifolium subterranium, было описано состояние, названное “клеверная болезнь” и характеризовавшееся нарушением функции яичников и резким снижением плодовитости вплоть до бесплодия. “Клеверную болезнь” связали с преобладанием в пище животных клевера, богатого куместролом и предшественниками эквола фомононетином и дэйдзеином, относящимися к классу изофлавоноидов [42, 49]. Как оказалось, изофлавоноиды составляют 5% сухой массы этого вида растения. Большое количество куместрола и других фитоэстрогенов, в частности биоканина А обнаружили также в люцерне. Позднее симптомы “клеверной болезни” были описаны у крупного рогатого скота, кроликов и некоторых видов оленей. Кроме того, у самок животных, питавшихся богатыми изофлавоноидами растениями, отмечено появление (вне беременности) признаков лактации; это явление наблюдалось даже у самцов [48, 53]. У баранов, питавшихся клевером subterranium, отметили снижение концентрации сперматозоидов в эякуляте [29]. Как считают, в механизме описанных расстройств основным является нарушение рецепции эндогенных эстрогенов гормоночувствительными клетками гипоталамуса, вследствие интенсивного связывания с ними фитоэстрогенов. Ряд авторов [26, 28] осмыслили это явление с эволюционных позиций. По их мнению, в течение длительного времени (эпох) формировались экофизиологические взаимоотношения между флорой и фауной. Являясь основным источником пищи для травоядных животных, выступающих по отношению к растениям “в роли хищников”, растения выработали своеобразный механизм защиты от полного уничтожения посредством синтеза веществ с эстрогенными свойствами и “регулирования” численности стад травоядных животных путем снижения их плодовитости. При этом эволюционный процесс шел по пути адаптации животных к фитоэстрогенам, выработки способности эффективной их метаболизации и быстрого выведения из организма. Установлено [46], что в печени фитоэстрогены подвергаются конъюгации с глюкуроновой кислотой, и в виде такого комплекса экскретируются с желчью или мочой. Важно отметить, что фитоэстрогены неспособны депонироваться в организме. Что касается человека, то в настоящее время фактические данные о влиянии потребления пищи, богатой фитоэстрогенами, на репродуктивную функцию немногочисленны. В первую очередь это связано с тем, что изучение действия фитоэстрогенов требует длительных и сложных (прежде всего из-за трудностей подбора контрольных групп) исследований. Имеющиеся данные ограничиваются пока небольшим числом фактов. Из древней Греции, Египта, стран Востока, от Гиппократа, Авиценны и других врачей и ученых древних и средних веков пришли сведения об использовании ряда растений и овощей, богатых фитоэстрогенами, в качестве контрацептивных средств или, наоборот, – стимуляторов фертильности: так называемая “плодотворная пыль”, образующаяся при обработке зерна, некоторые виды моркови и капусты (брокколи), гранаты, вытяжки из ряда растений – ириса, псореллы, софоры и др.) [20]. В наше время выполнено несколько краткосрочных наблюдений, касающихся особенностей менструальной функции женщин, в диэту которых включали большое количество фитоэстрогенов. Ежедневное (в течение 3-4 недель) потребление рациона, содержащего 60 г соевого белка, что эквивалентно 45 мг изофлавоноидов, приводило к увеличению (на 1–6 дней) менструального цикла за счет фолликулярной фазы, а также к супрессии пиков ФСГ и ЛГ в середине цикла [15]. Сходные результаты были получены при добавлении в пищевой рацион семян льна [41]. Проявления эстрогенного воздействия (по состоянию влагалищного эпителия) в результате потребления богатой фитоэстрогенами пищи были обнаружены и у женщин, находящихся в постменопаузе [56]. Следует также отметить данные о том, что имеется прямая корреляция между количеством потребляемых пищевых растительных волокон и возрастом менархе, обратно коррелирующим, в свою очередь, с уровнем продукции эстрогенов яичником девочки, а также прямая корреляция продолжительности менструального цикла с потреблением продуктов, богатых фитоэстрогенами [15]. Интересно отметить также, что в странах Азии, где растительная пища (и прежде всего продукты из сои) является традиционно преобладающей, расстройства, связанные с наступлением менопаузы (остеопороз, приливы, кардиопатии и др.), встречаются в значительно менее выраженной форме, чем на Западе [9]. Установлено также, что у мужчин этих стран отсутствовала или была выражена в значительно меньшей степени отмеченная у мужчин Америки и Европы тенденция к прогрессивному снижению за последние 50 лет средней концентрации сперматозоидов в эякуляте [51]. Значительно большее количество информации по этой проблеме получено в эксперименте, тем более что к концу 60-х годов многие фитоэстрогены были получены в очищенном виде [20]. Особенно удобными для анализа оказались модели неполовозрелы и овариэктомированных животных. Результаты работ разных авторов оказались, однако, неоднозначными. Так, С. Burroughs и cоавт. [14] показали, что введение с молоком новорожденным самкам кроликов и мышей куместрола приводило к изменениям, сходным с наблюдавшимися при введении синтетического эстрогена диэтилстильбэстрола увеличению массы матки, ороговению влагалищного эпителия, плоскоклеточной метаплазии эндометрия, преждевременному открытию влагалища, появлению слизистой пробки в шеечном канале, изменению полового поведения и т.п. При скармливании в течение 4–6 дней неполовозрелым кроликам рациона, содержащего 11 мг/10 г дейдзеина отмечалось увеличение веса матки с 9,6 до 25 г [12]. К. Faber и С. Hughes [19] давали новорожденным крысам с пищей генистейн, а в постпубертатном возрасте кастрировали самок. После этого они вводили им гонадотропин-рилизинг гормон для изучения реакции на него гопофиза. Авторы установили, что результатом неонатального введения генистейна было увеличение размеров ядер преоптической зоны гипоталамуса. Последующая реакция на гонадотропин-рилизинг гормон у половозрелых крыс с удаленными яичниками зависела от количества введенного в неонатальном возрасте генистейна: чем выше доза этого фитоэстрогена, тем слабее проявлялась реакция гипофиза на введение рилизинг гормона. При изучении реакции матки неполовозрелых крыс на введение куместрола и зирелинона [22, 32] установлено, что характер действия этих фитоэстрогенов (эстрогенное – антиэстрогенное) зависит от способа введения (однократное или дробное) и дозы препаратов. Заслуживает внимания работа С.Awoniji и cоавт. [7], изучавших влияние фитоэстрогенов на развитие репродуктивной системы крыс. Для этого самки с 17-го дня беременности (время появления у эмбрионов эстрогензависимых зачатков репродуктивной системы) и до момента родов получали генистейн в дозе 5 мг/кг. Далее генистейн в той же дозе вводили новорожденным самкам до 21 (1-я группа) и 70 (2-я группа) дней постнатальной жизни, после чего вскрывали животных. Обнаружено, что масса яичников и матки у животных 1-й группы была достоверно меньше, чем в контроле. При этом показатели количества и степени развития фолликулов, желтых тел и элементов “интерстициальной железы” у этих крыс были также снижены по сравнению с контролем. Одновременно обнаружено достоверное снижение уровня эстрадиола и прогестерона в крови, которое авторы связали с нарушением процессов дифференциации клеточных структур фолликула, обусловленных, в свою очередь, задержкой дифференциации cтруктур гипоталамуса. У потомства 2-й группы изменений массы яичников и матки, а также гормональных нарушений не отмечалось. Однако у этих самок, а также у самок, получавших генистейн до 21 дня, но вскрытых на 70-й день, в яичниках наблюдались кистозные образования типа цистаденом, происходящие из rete оvarii. На основании полученных данных авторы сделали два основных вывода: 1) экспозиция к фитоэстрогенам во внутриутробном и неонатальном периодах влияет на развитие органов репродуктивной системы экспериментальных животных, 2) фитоэстрогены оказывают свое действие в критические периоды пре- и постнатального онтогенеза репродуктивных органов. Заслуживает внимания обнаруженный авторами факт формирования под влиянием фитоэстрогенов опухолеподобных образований из элементов сети яичника, производных первичной почки, являющихся эмбриональным источником структур яичника (яичка) и надпочечников, продуцирующих стероидные гормоны [1]. Интересные результаты были получены и в опытах на овариэктомированных животных. У крыс, находившихся на рационе, содержавшем генистейн в концентрации 375 мкг/г, наблюдался выраженный утеро- и маммтропный эффекты [45], опосредуемые через гипоталамус, рецепторы нейронов которого и были, по мнению авторов, “точкой приложения” генистейна. Показано также, что куместрол, дейдзеин и генистейн вызывают гиперплазию клеток эндометрия половозрелых овариэктомированных крыс, что обусловлено способностью фитоэстрогенов, конкурирующих с эндогенным эстрадиолом за эстрогенные рецепторы, активировать в ядрах участки генома, контролирующие рост и дифференциацию клеток эндометрия [36]. По данным Y. Jiamazaki [27], изофлавоноид иприфлавин проявлял эстрогенные свойства у интактных половозрелых крыс, однако при введении его неполовозрелым и овариэктомированным животным этот эффект отсутствовал. P. Whitten и соавт [55] выявили способность куместрола стимулировалть рост матки у неполовозрелых животных и вызывать у них типичный эструс, а у половозрелых приводить к нарушениям эстрального цикла (персистирующий эструс) и секреции гонадотропинов. По мнению авторов, это связано с тем, что в разных условиях куместрол проявлял различные свойства: в одних случаях – эстрогенные (или усиливающие действие эндогенных эстрогенов), в других – антиэстрогенные. Отмечено также, что введение энтеролактона ингибирует стимулируемый эстрадиолом синтез РНК в эндометрии при введении энтеролактона за 22 ч до введения эстрадиола [54]. Интересное исследование провели Н. Boettgher-Tong и соавт. [13]. Они обнаружили, что некоторые образцы стандартного сертифицированного питания для лабораторных животных cодержат в своем составе в значительном количестве сою и люцерну (источники, богатые изофлавоноидами). Авторы в течение 10 дней содержали предварительно овариэктомированных самок крыс 20-дневного возраста на указанных образцах диеты (1-я группа). Самки 2-й группы получали питание, не содержащее ингредиентов, богатых фитоэстрогенами. В конце эксперимента при исследовании органов у животных 2-й группы матка и яйцеводы не имели каких-либо признаков дополнительного эстрогенного воздействия, в то время как у животных 1-й группы рога матки были увеличены в размерах, отечны и гиперемированы, отмечалось утолщение вагинального эпителия, т.е. имелись выраженные признаки эстрогенного влияния. Поэтому ряд исследователей [13,52] рекомендуют при изучении в эксперименте вопросов, касающихся действия гормонов, учитывать характер питания экспериментальных животных . G. Fredricks и cоавт. [23] при введении куместрола самкам крыс обнаружил двукратное уменьшение частоты овуляции и увеличение с 3 до 46% частоты внутриутробной гибели эмбрионов на ранних этапах развития. Снижение частоты овуляции авторы связали с возникающей после введения куместрола супрессией секреции гипофизом ФСГ, а учащение гибели зародышей - с нарушением (задержкой) овуляции и, как следствием последней, - перезреванием яйцеклетки. Заслуживает внимания работа R. Mathieson и W. Kitts. [37], показавших, что добавление куместрола и генистейна к цитозолю клеток гипоталамуса и гипофиза приводит к снижению связывания этими структурами 3Н-эстрадиола, подтверждающему наличие эффекта “соревнования за рецепторы” между эндогенными и экзогенными эстрогенами. Для уточнения характера действия фитоэстрогенов на эстрогензависимые структуры привлечена также модель культуры эстрогенчувствительных клеток рака молочной железы человека линии МСF-7 и T-47D [17, 25, 38]. Обнаружено, что фитоэстрогены энтеролактон, зирелинон, синтетический аналог последнего – зирелон, генистейн и биоканин А проявили свойства как ингибиторов, так и стимуляторов роста злокачественных клеток in vitro. При этом характер действия использованных фитоэстрогенов зависел от их концентрации: при высоких значениях концентрации (свыше 10 мМ) происходило торможение роста клеток, при низких – стимуляция. Отмечено также, что при введении в культуральную среду эстрадиола стимулирующий эффект фитоэстрогенов не проявлялся. Он подавлялся также с помощью тамоксифена – препарата, обладающего антиэстрогенными свойствами. Таким образом, представленные экспериментальные данные позволяют сделать вывод о том, что фитоэстрогены способны модулировать специфические ответы тканей-мишеней репродуктивных органов и, следовательно, влиять на рецепцию, продукцию и метаболизм эндогенных гормонов, а также на их действие на клеточном уровне. При этом в зависимости от уровня в организме эндогенных эстрогенов, метаболических форм фитоэстрогенов, способности (affinity) последних связываться с рецепторами, состояния репродуктивной системы в момент воздействия, особенностей введения (однократно, дробно, длительно) они могут выступать в роли как агонистов, так и антагонистов собственных эстрогенов организма. Свойства агонистов и антагонистов эндогенных стероидов зависят у фитоэстрогенов и от их дозы (концентрации) – чем она выше, тем более выражен антиэстрогенный эффект. Гормоноподобная активность фитоэстрогенов может быть связана, как полагают некоторые авторы, и с другими механизмами. Выявлена способность фитоэстрогенов стимулировать образование в печени глобулинов, связывающих половые стероиды [4], и таким путем модулировать биологическую активность эндогенных половых гормонов. Установлено, что ряд изофлавоноидов и лигнанов, влияя на активность ферментов ароматазной системы, могут ингибировать переход андростендиона в эстрон, а последнего – в 17-бета эстрадиол [24]. Показано также, что изофлавоноид генистейн ингибирует активность тирозинспецифической протеинкиназы, “работающей на уровне рецепторов”, к ряду ростовых факторов: эпидермальному, инсулиноподобному, тромбо- и моноцитарному, играющих важную роль в регуляции процессов пролиферации и трансформации клеток [49]. Хотя влияние фитоэстрогенов оказывается, как правило, минимальным, при определенных условиях оно может вызывать нарушения полового цикла и репродуктивной функции. Однако для более полного представления о характере этих процессов требуются дальнейшие исследования. Значительно большее число работ посвящено роли гормоноподобных соединений растительного происхождения как протекторов, препятствующих развитию гормонозавимых пролиферативных и опухолевых процессов. При рассмотрении этой проблемы обратили внимание на данные эпидемиологических исследований о том, что возникновение ряда опухолей (молочной железы, предстательной железы, толстой кишки) и некоторых неопухолевых гормонально-зависимых заболеваний, в том числе сердечно-сосудистых, коррелирует с содержанием в пищевом рационе больных продуктов растительного или животного происхождения. Отмечено [6, 44], что так называемая “западная диета”, характеризующаяся преобладанием мясомолочных, с высоким содержанием животного белка и жиров продуктов (в отличие от вегетарианской или полувегетарианской пищи народов развивающихся стран Азии, Японии, Китая и некоторых стран северной Европы) ассоциируется с более частым возникновением названных выше опухолевых и опухолеподобных процессов. В первую очередь было обращено внимание на рак молочной железы и предстательной железы, которые в промышленно развитых странах как причина смерти от злокачественных опухолей начинают прочно занимать лидирующие позиции. Представляют интерес данные [5] об уровне экскреции с мочой фитоэстрогенов (показатель уровня их потребления) у здоровых людей и имеющих упомянутые опухоли. Так, у пожилых здоровых женщин штата Массачусетс (США), а также в Бостоне и Хельсинки обнаружена высокая экскреция с мочой лигнанов. В Бостоне и Финляндии у больных раком молочной железы и в группах риска по развитию этой патологии экскреция лигнанов и изофлавоноидов была наименьшей. У здоровых молодых женщин Бостона и Хельсинки, пища которых содержала значительные количества мясожиромолочных продуктов, экскреция лигнанов и изофлавоноидов с мочой также была низкой. Изучение характера питания у больных раком молочной железы женщин Бостона и Финляндии обнаружило существенное отличие от контингента здоровых женщин: для группы больных раком молочной железы характерно очень низкое потребление в пищу продуктов из цельного зерна. Показано, что у жителей Японии и Китая, рацион которых содержит большие количества соевых бобов и продуктов из цельного зерна, а также продукты, богатые растительными волокнами, также определяется высокий уровень экскреции фитоэстрогенов [4]. У женщин Финляндии, у которых рак молочной железы встречается достоверно реже, чем у женщин Бостона, обнаружена положительная корреляция между экскрецией с мочой лигнанов и изофлавоноидов и уровнем глобулинов, связывающих половые гормоны, и отрицательная корреляция с уровнем в крови свободного эстрадиола. Последний, как известно, играет существенную роль в генезе рака молочной железы. У больных раком молочной железы количество в крови связывающего половые гормоны глобулина было наименьшим [5]. Следует также отметить следующие наблюдения. КАК УЖЕ УПОМИНАЛОСЬ, имеется зависимость между уровнем потребления пищевых растительных волокон и возрастом менархе. При этом для женщин с ранним менархе была характерна и более высокая продукция яичниками эстрогенов, и большая частота развития рака молочной железы [5]. Выше уже было отмечено об увеличении продолжительности менструального цикла у женщин, находящихся на диете с большим содержанием сои. В то же время отмечено, что у женщин азиатских народов, у которых рак молочной железы встречается реже, средняя продолжительность цикла на 2–3 дня больше, чем у женщин западных стран [15]. Ряд исследователей обратили также внимание на то, что наблюдающаяся в последние десятилетия тенденция снижения концентрации сперматозоидов у мужчин Америки и Европы не является характерной для мужчин стран Азии [51]. Ценные сведения были получены в эксперименте. В опытах на крысах удалось показать, что скармливание животным пищи, содержащей значительные количества соевых бобов или изготовленных из них чипсов, богатых изофлавоноидами генистейном и дейдзеином, достоверно снижает частоту возникновения экспериментального (“бензантраценового”) рака молочной железы, а также тормозит развитие уже возникшей опухоли [8, 33]. В условиях культуры клеток рака молочной железы, кроме упомянутых выше данных о действии на рост этих клеток фитоэстрогенов, выявлена также способность фитоэстрогенов влиять на экспрессию онкогенов и трансформирующих факторов роста. Это установили для дейдзеина, эквола, метайрезинола, изосекоцирезинола и энтеролактона в отношении экспрессии семейства генов Src ретровирусов, ответственных, в частности, за развитие рака молочной железы мышей [39]. При содержании трансгенных мышей, носителей онкогенаc-neu(erb B2) на диете, богатой пищевыми растительными волокнами, отмечено уменьшение частоты спонтанного возникновения опухолей молочной железы [43]. Авторы связывают это с антиэстрогенным действием содержавшихся в пище фитоэстрогенов. Выше уже упоминалось, что лигнаны и изофлавоноиды влияют на активность ферментов ароматазной системы и могут таким образом замедлять конверсию андростендиона в эстрон, т.е. снижать риск возникновения эстрогензависимого рака молочной железы [24, 30]. Учитывая, однако, наличие разнонаправленного действия фитоэстрогенов (агонистическое или антагонистическое) по отношению к эндогенным эстрогенам, в последнее время высказывается мнение и о возможности приобретения ими, в частности зирелиноном, (в определенных условиях) канцерогенных свойств. Важные эпидемиологические данные были получены в отношении рака предстательной железы. Оказалось, что в Японии, Китае и ряде других стран Азии, несмотря на примерно одинаковую с жителями стран Запада частоту латентных и “малых” форм рака простаты, клиническая манифестация и смертность от этого вида опухоли в 80–100 раз меньше [57]. Низкая частота рака предстательной железы характерна и для адвентистов, в диету которых традиционно включаются в большом количестве соевые бобы, чечевица, орехи, сухие фрукты. В то же время в отдельно изученной группе мужчин-японцев, потреблявших преимущественно жирную и мясную пищу, частота рака предстательной железы и смертность от него были выше. Анализируя причины указанного явления, авторы приходят к выводу о наличии связи процесса прогрессирования рака простаты с содержанием в потребляемых жителями этих стран продуктов из сои и других зерновых культур, что подтверждается высокими показателями экскреции с мочой изофлавоноидов. Интересно отметить, что у иммигрантов из азиатских стран после их переезда на Запад и изменения характера питания на “западный” частота гормонально-зависимых заболеваний, в том числе опухолевых процессов в предстательной железе, становится такой же, как у коренных жителей [47]. Хотя в Финляндии, особенно в северных районах, довольно высоко потребление в пищу жира, частота рака предстательной железы у финнов ниже по сравнению с американцами, хотя и выше, чем у японцев. Такие результаты объясняются, как считают, тем, что в диете финнов используется больше продуктов из цельного зерна, чем у американцев [5]. Хорошо известны клинические данные о благоприятном клиническом эффекте синтетических эстрогенов, препятствующих прогрессированию рака предстательной железы у человека. Это подтверждает возможность наличия защитных свойств в отношении развития рака предстательной железы и у фитоэстрогенов. Хотя активность фитоэстрогенов значительно слабее, чем у естественных гормонов, постоянное поступление их в организм с растительной пищей может, как уже упоминалось, сопровождаться повышением их концентрации до величин, способных, очевидно, блокировать эстрогенные рецепторы нейронов гипоталамуса и таким образом тормозить продукцию ЛГ и, соответственно, андрогенов, снижая риск развития и прогрессирования эстрогензависимых опухолей. Примечательно, что попытки в эксперименте на мышах предотвратить с помощью куместрола развитие в неонатальном периоде диспластических процессов в предстательной железе введением беременным самкам диэтилстильбэстрола, не увенчались успехом. Однако развитие этих процессов у потомства предотвращалось, если самки с момента зачатия находились на диете, содержащей значительное количество продуктов из сои [34]. При индукции рака предстательной железы в эксперименте у половозрелых крыс отмечено. что латентный период развития опухоли увеличивался при содержании животных на диете, богатой генистейном и дейдзеином [41]. Имеются данные о влиянии фитоэстрогенов на опухолевые процессы и других локализаций. Так, установлено, что содержание мышей на диете, включающей 30% соевых бобов, снижало частоту развития у животных экспериментального (“нитрозаминового”) рака печени [5]. Высказана также точка зрения, что противоопухолевый эффект может быть обусловлен не только эстрогенподобными свойствами фитоэстрогенов, но и другими механизмами, в частности их способностью ингибировать ангиогенез, а также их антиоксидантными свойствами [34]. Таким образом, эпидемиологические и экспериментальные данные позволяют реально связать степень содержания в пищевом рационе фитоэстрогенов с прогнозом возникновения и прогрессирования гормонально-зависимых опухолевых процессов и ряда других заболеваний. В то же время условия и точные механизмы действия фитоэстрогенов на развитие опухолей и других патологических процессов, как и их роль в развитии рассмотренных в начале статьи нарушений функции репродуктивной системы, не до конца ясны. Учитывая изложенные выше факты, можно полагать. что фитоэстрогены, выступая в роли агонистов или антагонистов эндогенных эстрогенов способны “вмешиваться” в процессы, связанные с размножением как нормальных, так и злокачественно трансформированных клеток. Безусловно, однако, что они не выступают при этом в качестве первичного стимула опухолевого роста. Вероятно, они играют роль фактора, влияющего на уже развившийся процесс. Отсутствие полной ясности в этих вопросах не позволяет пока широко рекомендовать конкретные методы направленной терапии гормонально-зависимой патологии человека, в том числе опухолей, с помощью фитоэстрогенов. Тем не менее симптоматично отметить, что уже и в научной литературе появляются сообщения об успешных попытках использования онкологами на практике сертифицированных растительных пищевых смесей и добавок, содержащих соединения с эстрогенной активностью, для лечения опухолей молочной железы и предстательной железы [18]. А.И. Никитин Балтийский Институт репродуктологии человека, Санкт-Петербург Литература 1. Никитин А.И. Проблемы ранней дифференциации гонад млекопитающих (эмбриональный гистогенез и механизмы регуляции). Архив анат гистол эмбриол 1985;84:8:3–10. 2. Аdams N.R., Oldham C.H., Reydon R.A. Ovulation rate and oocyte numbers in ewes after exposure to oestrogenic pasture. J Reprod Fertil 1979;55:88–89. 3. Ayres D.C., Loike J.D. Lignans. Chemical, biological and clinical properties. In: Chemistry & Pharmocology of Natural Products. Ed.:Phillipson J.D., Ayres D.C., Baxter H. Cambrige University Press. 1990;402. 4. Aldercreutz H., Markkanen H., Watanabe S. Plasma concentration of phytoestrogens in Japanese men. Lancet 1993;342:1209–1210. 5. Aldercreutz H. Phytoestrogens: epidemiology and a possible role in cancer protection. Environ Health Persp 1995;103:suppl.:7:103–112. 6. Aldercreutz H. Phytoestrogens and Western diseases. Ann Med 1997;29:95–120. 7. Awoniji C.A., Roberts D., Rao Veeramachaneni D.N. et al. Reproductive sequelae in female rats after in utero and neonatal exposure to the phytoestrogen genistein. Fertil Steril 1998;70:440–447. 8. Barnes S. Effects of genistein on in vitro and in vivo models of cancer. J Nutr 1995;125:777–783. 9. Barrett J. R. Phytoestrogens: friends or foes? Environ Health Persp 1996;104:478–482. 10. Barrett J. R. Mycotoxins: of molds and maladies. Environ Health Persp 2000;108:A20-23. 11. Bennets H., Underwood E.J., Shier F.L. A specific breeding problem of sheep on subterranean clover pasture in Western Australia. Aust Vet J 1946;.22:.2–12. 12. Biskoff E.V., Livingston A.L., Hendrickson, Booth A.W. Relative potencies of several estrogene-like compounds found in forages. Agric Food Chem 1962;10:410–412. 13. Boettger-Tong H., Murthy L., Chiapetta C. et al. A case of a laboratory animal feed with hifh estrogenic activity and its impact in vivo resposes to exogenously administered estrogens. Environ Health Persp 1998;106:369–373. 14. Burroughs C.D., Mills K.T. Bern H.A. Reproductive abnormalities in female mice exposed neonatally to various doses of coumestrol. J Toxicol Environ Health 1990;30:105–122. 15. Cassidy A., Bingham S., Setchell K. Biological effects of a diet of soy protein rich in isoflavones on the menstrual cycle of premenopausal women. Am J Clin Nutr 1994;60; 333–340. 16. Coward L., Barnes N., Setchell K., Barnes S. Genistein, diadzein and their beta-glycoside conjugates-antitumor isoflavones in soybean foods from American and Asian diets. J Agric Food Chem 1993;41:1961–1967. 17. Dees C., Foster J.S., Ahamed Sh., Wimalasena J. Dietary estrogens stimulate human breast cells to enter the cell cycle. Environ Health Persp 1997;105:suppl.:3:633–636. 18. DiPaola R., Gallo M. In: “Forum”: Herbal medicine is potent estrogen. Enwiron Health Persp 1999;107:A137–139. 19. Faber K.A., Hughes C.L. Dose-response characteristics of neonatal exposure to genistein on pituitary responsiveness to gonadotropin realising hormone and volume of the sexually dimorphic nucleus of the preoptic area in postpubertal castrated female rats. Reprod Toxicol 1993;7:35–39. 20. Farnesworth N.R.,Bingel A.S., Cordell G.A. et al. Potential value of plants as sources of new antifertility agents. J Pharm Sci 1975;7;717–754. 21. Finlay E.M.,Wilson D.W., Aldercreutz H., Griffiths K. The identification and measurement of phytoestrogens in human saliva, plasma, breast aspirate or cyst fluid and prostatic fluid using gas chromatography-mass spectrometry. Endocrinology 1991;12:suppl:49. 22. Folman Y., Pope G. Effect of norethisterone acetate dimethylstilboestrol, genistein and coumestrol on uptake of 3H-oestradiol by uterus vagina and skeletal muscle of immature mice. J. Endocrinol 1969;44:213–218. 23. Fredricks G.R., Kincaid R.L., Bondioli K.R., Wright R.W. Ovulation rates and embryo degeneracy in female mice fed the phytoestrogen coumestrol. Proc Soc Biol Med 1981;167:237–241. 24. Henderson B.E., Ross R., Bernstein L. Estrogens as a cause of human cancer: the Richard and Hinda Rosenthal foundation award lecture. Cancer Res 1988;48:246–253. 25. Hoffman R. Potent inhibition of breast cancer cell lines by the isoflavonoid kievetone: comparison with genistein. Biochem Biophys Res Com 1995;211:600–606. 26. Huges C.L. Phytochemical mimicry of reproductive hormones and modulation of herbivore fertility by phytoestrogens. Environ Healph Persp 1988;78:171–175. 27. Jiamazaki Y. Effect of ipriflavone on the response of the uterus and thyroid to estrogen. Lancet 1993;342:1209–1210. 28. Jansen D.H. When is it coevolution? Evolution 1980;34:611–612. 29. Kaldas R.S., Hughes G.L. Reproductive and general effects of phytoestrogens in mammals. Reprod Toxicol Rev 1989;3:81–89. 30. Kellis J.T., Vickery L.E. Inhibition of human estrogens synthetase (aromatase) by flavones. Science 1984;225:1032–1034. 31. Kelly G.F., Nelson C., Waring M.A. et al. Metabolites of dietary (Soya) isoflavones in human urine. Clin Chem Acta 1993;223:9–22. 32. Kitts W.D., Newsome F.E., Runeckles V.C. The tstrogenic and antiestrogenic effects of coumestrol and zerananol on the immature rat uterus. Can J Anim Sci 1983;63:823–824. 33. Lamartiniere C.A., Moore J., Holland M., Barnes S. Neonatal genistein chemoprevents mammary cancer. Proc Soc Exp Biol Med 1995;208:120–123. 34. Makela S., Santti R., Salo L.,McLachlan A. Phytoestrogens are partial estrogen agonist in the adult mouse. Environ Health Persp 1995;103:suppl:7:123–128. 35. Martin P.M., Horwitz K.B., Rujan D.S., McGuire W.L. Phytoestrogen interaction with estrogen receptors in human breast cancer cells. Endocrinology 1972;52:299–310. 36. Markaverich B.M., Webb B., Densmore Ch.L., Rebecca R.G. Effects of coumestrol on estrogen receptor function and uterine growth in ovaiectomized rats. Environ Health Persp 1995;103:574–581. 37. Mathienson R.A., Kitts W.D. Binding of phytoestrogens and oestradiol-17b by cytoplasmic receptors in the pituitary gland and hypothalamus of the ewe. J Endocrinol 1980;85:317–325. 38. Mousavi Y., Aldercreutz H. Enterolactone and estradiol inhibit each others proliferative effect on MCF-7 breast cancer cells in culture. J Steroid Biochem Mol Biol. 1992;41:615–619. 39. Ogavara H., Akiyama T., Watanabe S. et al. Inhibition of tyrosine protein kinase activity by synthetic isoflavones and flavones. J Antibiot 1989;42:350–358. 40. Phipps W.R., Martini M.C., Lampe J.W. et al. Effect of flaxseed ingestion on the menstrual cycle. J Clin Endocrinol Metab 1993;72:1215–1219. 41. Pollard M., Luckert P.H. Influence of isoflavones in soy protein isolates on development of indused prostate-related cancers in rats. Nutr Cancer 1997;28:41–45. 42. Price K.R., Fenwick G.R. Naturally occuring oestrogens in foods – a review. Food Addit Contam 1985;2;73–106. 43. Rao G.M., Ney E., Herbert R.A. Influence of diet on mammary cancer in transgenic mice bearing on oncogene expressed in mammary tissue. Breast Cancer Res Treat 1997;45:149–158. 44. Rose D.P., Boyar A.P., Wynder E.L. International comparison of mortality rates for cancer of the breast, ovary, prostate and colon and per capita food consumption. Cancer 1986;58:2363–2371. 45. Santell R.C., Chang I.C., Nair H.G., Helferich W.G. Dietary genistein exerts estrogenic effects upon the uterus, mammary gland and the hypothalamic/pituitary axis in rats. Am Soc Nutr Sci 1997;127:263–269. 46. Setchel K.D., Aldercreutz H. Mammalian lignans and phytoestrogens. In: Role of the Gut flora in toxicity and Cancer. Ed.:Rowland J. London. Academic Press 1988;315–345. 47. Shimizu H., Ross R.K., Bernstein L. et al. Cancer of the prostate and breast among Japanise and white immigrants in Los-Angeles County. Br J Cancer 1991;6:963–966. 48. Shutt D.A. The effect of plant oestrogens on animal reproduction. Endeavor 1976;35:110–113. 49. Shutt D.A., Cox R.L. Steroid and phytoestrogen binding to sheep uterine receptors in vitro. J Endocrinol 1972;52:299–310. 50. Stitch S.R., Toumba J.K., Groen M.B. et al. Excretion, isolation and structure of a phenolic constituent of female urine. Nature 1980;287:738–740. 51. Swan S.H., Eluin E., Fenster L. Response: a reanalysis of sperm density data. Environ Health Persp 1998;106:368–369. 52. Thigpen J.E., Setchell D.R., Goelz M., Forsythe D.B. The phytoestrogen content of rodent diets. Environ Health Persp 1999;107:.A182–183. 53. Thrain R.L. Bovine infertility caused by subterranian clover: further report and herd histories. Aust Vet J 1966;42:199–203. 54. Waters A.P., Knowler J.T. Effect of a lignan on RNA synthesis in the rat uterus. J Reprod Fertil 1982;66:379–381. 55. Whitten P.L., Russel E., Naftolin F. Effects of normal, human-concentration, phytoestrogen diet on rat uterine growth. Steroids 1992;57:98–106. 56. Wilcox G., Wahlquis L., Burger H.G., Medley G. Oestrogenic effects of plant foods in postmenopausal women. Br Med J 1990;301:905–906. 57. Yatani R., Chigusa J., Akazaki K. et al. Geographic pathology of latent prostatic cancer. Int J Cancer 1982;29:611–616. |