Тестирование микроделеций на Y-хромосоме у пациентов с различными нарушениями сперматогенеза.
|
В последние годы при лечении бесплодия используются новые вспомогательные репродуктивные технологии, такие как ИКСИ, ПЕЗА, ТЕЗА, которые позволяют иметь детей супружеским парам, где мужья страдают тяжелыми формами бесплодия. Большой процент в этиологии такого рода заболеваний занимает генетический фактор.
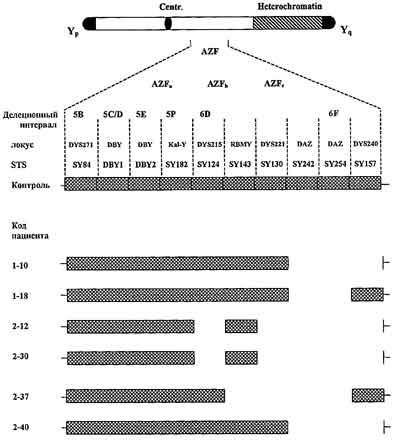
Более двух десятилетий назад L.Tiepolo и O. Zuffardi [26] обнаружили микроделеции на длинном плече Y-хромосомы у пациентов с азооспермией. Они предположили наличие группы генов, ответственных за инициацию и поддержание нормального сперматогенеза у мужчин. Позже этот участок Y-хромосомы был обозначен как "фактор азооспермии" (AZF), в нем было выделено три неперекрывающихся функциональных участка - AZFa, AZFb и AZFc [13, 26, 28-30]. К настоящему времени в AZF локусе Y-хромосомы изучены несколько десятков генов и установлена зависимость между микроделециями, которые включают некоторые из этих генов, и различными формами мужского бесплодия [1]. У инфертильных пациентов Y-микроделеции присутствуют с частотой до 55% [9, 10]. При выявлении Y-микроделеций и последующем проведении ИКСИ возникают определенные проблемы: во-первых, высока вероятность передачи сыновьям генетических дефектов, вызванных микроделециями; во-вторых, необходим выбор правильной терапии мужского бесплодия, так как установление факта наличия микроделеции позволяет избежать у пациентов ненужного гормонального или хирургического лечения. Размер и характер микроделеций могут иметь прогностическое значение в плане возможности получения мужских половых клеток, пригодных для проведения ИКСИ. В настоящей работе представлены результаты по тестированию Y-микроделеций у пациентов с различными нарушениями сперматогенеза. Материал и методы С целью уточнения частоты встречаемости микроделеций в AZF-регионе Y-хромосомы у пациентов с выраженными нарушениями сперматогенеза, определения их особенностей (характера локализации, размеров), а также практической значимости такого скрининга, нами проведено генетическое тестирование методом полимеразной цепной реакции (ПЦР) ДНК, выделенной из крови, полученной от 68 инфертильных пациентов в возрасте от 19 до 42 лет (в среднем 32,1±3,4 года). Продолжительность бесплодия в семьях этих пациентов составила от 2 до 18 лет (в среднем 7,1±3,8 года). Обследование пациентов, помимо сбора анамнеза, включало общее и специальное андрологическое исследование, двукратное стандартное исследование спермы, определение в сыворотке крови уровня тестостерона, ФСГ, ЛГ, пролактина и эстрадиола иммуноферментным методом. В результате проведенного обследования установлено, что 27 пациентов страдают необструктивной формой азооспермии (1-я группа), 25 пациентов - тяжелой олигозоооспермией с концентрацией сперматозоидов менее 5 млн мл (2-я группа), 16 пациентов - умеренной олиго- (более 5 млн сперматозоидов в 1 мл) и/или тяжелой формой астенотератозооспермии (3-я группа). Для проведения ПЦР ДНК выделяли из лейкоцитов венозной крови путем добавления протеиназы К с последующей депротоинизацией фенол-хлороформом и осаждением этанолом. В качестве примеров использовали набор из 10 пар Y-специфичных STSS, которые перекрывают эухроматиновый участок Yq и затрагивают важные участки Y-хромосомы, содержащие гены, ответственные за сперматогенез: DBY, Kal-Y, RBMY и DAZ. Все STSs были предварительно описаны в литературе, мы использовали последовательности и порядок расположения STSs, предложенные D.Vollrath и соавт. [31], R.Reijo и соавт. [20] и C.Foresta и соавт. [6, 7]: 1) для AZFa - DBY1, DBY2, sY 84 и KAL-Y, интервал 5С - 5D; 2) для AZFb - sY124; sY130; sY143, интервал 5P - 6D; 3) для AZFc - sY242; sY254; sY157; интервал 6E - 6F. В качестве отрицательного контроля проводили мультиплексный анализ ПЦР, используя ДНК женщины и 3 STS, охватывающих 3 участка AZF (DBY1, sY130, sY254), в качестве положительного контроля - ДНК фертильного мужчины, протестированную теми же 10 парами STSs. ПЦР проводили в 25 мкл реакционной смеси, содержащей 20 нг геномной ДНК, 0,3 мкмоль каждого праймера, 200 мкмоль dNTPs, 1 ед. Taq-полимеразы и буфер (67 мM трис-HCl, pH 8,6; 2,5 MgCl, 16,6 мM (NH)SO.; 0,001% Тритон X-100), в режиме: 95 °C - 1 мин, 59 °C - 1 мин, 72 °C - 1 мин, число циклов - 30. Продукты амплификации разделяли в 2% агарозном геле, который содержал 0,5мкг/мл бромида этидия для окрашивания ДНК. Делеция определенного локуса считалась достоверной, если результат повторялся в двух последующих независимых ПЦР. Результаты В 68 протестированных пробах обнаружено 6 (8,82%) микроделеций (см. таблицу), из них 5 (18,5%) делеции - в 1-й группе пациентов и 1 (4%) - во 2-й группе. Характеристика пациентов имеющих микроделеции Y-хромосомы
У пациента 1-10 с тяжелой формой олигозооспермии делеция охватывала участок хромосомы, расположенный между 242 и 254 STSs; у него были делетированы DAZ гены в AZFс участке (см. рисунок). У пациентов 1-18 и 2-37 делеции также располагались в AZFс участке, но имели больший размер (захватывали участок между 242, 254 и 157 STSs). В двух других случаях (2-12, 2-30) микроделеции, затрагивающие AZFc и AZFb участки, были одинаковыми и включали 124, 130, 242, 254 и 157 STSs. Причем у одного из этих пациентов (2-30) при кариотипировании была выявлена терминальная делеция участка Yq хромосомы, 46,XYq -[del(Y)(q11.22-qter)]. У пациента 2-37 делеция частично затрагивала как AZFb, так и AZFc (130, 242, 254 STSs). Все эти пациенты кроме пациента 1-10, страдали азооспермией. Ни у одного из пациентов не было выявлено делеций в AZFa-участке.
Обсуждение Общеизвестно, что 10-15% супружеских пар страдают той или иной формой бесплодия, причем в 35-50% случаев причиной бесплодия являются различные в том числе и генетического происхождения патологии у мужей [14]. Частота встречаемости микроделеций в AZF регионе Y-хромосомы у мужчин, страдающих бесплодием, варьирует в различных исследованиях от 1% [27] до 55% [3, 4, 8-10]. При обследовании бесплодных пациентов ПЦР анализ Y-хромосомы выполняется довольно редко. При этом до сих пор нет единого мнения, в каких случаях следует проводить такой анализ и сколько и каких STSs использовать при его проведении. Для анализа AZF-региона используют от 3 до нескольких десятков праймеров [17, 18, 19, 23]. Мы применили 10 пар праймеров, охватывающих наиболее важные участки локуса и позволяющих выявить большинство делеций в этом регионе. По данным опубликованных в литературе результатов обследования более 3000 бесплодных мужчин, микроделеции выявляются в 7,3% случаев [23, 25]. При этом наибольшая их часть обнаруживается при идиопатической азооспермии (15-50%), при тяжелых формах олигозооспермии (7-10%) [10-12]. Результаты наших исследований согласуются с вышеприведенными данными. Так, в группе страдающих азооспермией частота AZF-микроделеций составила 18,5%. В группе с тяжелой формой олигозооспермии она оказалась ниже - 4%. Наши результаты, как и данные литературы, свидетельствуют, что пациенты с одинаковым диагнозом имеют разный размер делеций. Естественно, возникает вопрос: размер и характер каких Y-микроделеций позволяет получить тестикулярные сперматозоиды или круглые/удлиненные сперматиды при проведение ТЕЗА, а какие Y-микроделеции точно указывают на полное отсутствие таковых даже при выполнении множественной открытой тестикулярной биопсии? Пока что трудно установить строгую корреляцию между типом делеции и патологии репродуктивной системы мужчины. Однако основываясь на данных литературы и результатах собственного исследования, мы уже можем говорить о прогностическом значении той или иной микроделеции. На основании этого можно прийти к следующим предположениям. У пациентов, несущих изолированную AZFc делецию (DAZ-гены), может наблюдаться гипосперматогенез или синдром клеток Сертоли II типа (СКС-II). В то же время известно, что при СКС-II могут быть обнаружены островки "нормального" сперматогенеза при выполнении мультифокальной множественной биопсии [2]. У половины пациентов, несущих такую AZFc-делецию, при ТЕЗА могут быть получены и успешно использованы в ИКСИ или КРИО-ИКСИ циклах тестикулярные сперматозоиды [2, 10, 15]. Делеции, включающие и выходящие за границы AZFc региона (AZFb+c и АZFa+b+c), по-видимому связаны с полным отсутствием тестикулярных сперматозоидов. Микроделеции, охватывающие только часть AZFb-региона, приводят к более гетерогенному фенотипу, включая и олигозооспермию, а затрагивающие весь AZFb регион (sY113-sY143) ведут к блоку сперматогенеза на стадии сперматоцитов или сперматид. Делеции, полностью удаляющие AZFb-, AZFa- иили AZFc-регионы, ассоциированы с СКС или блоком сперматогенеза. Делеции AZFa-региона (делеционный интервал 5C/D) наблюдаются реже и предположительно связаны с почти полным отсутствием зародышевых клеток - c СКС-I [11, 15]. Таким образом, микроделеций, затрагичающих DAZ-гены или даже целый AZFc-участок, по-видимому, недостаточно для полного прекращения сперматогенеза. В нашем исследовании пациент 1-10 c DAZ-делецией имел незначительное число сперматозоидов в эякуляте, которых было достаточно для проведения ИКСИ и достижения беременности. В то же время в эякулятах пациентов 1-18 и 2-37 полностью отсутствовали сперматозоиды. По данным литературы, частота оплодотворения при использовании сперматозоидов, полученных от пациентов, несущих AZF-микроделеции, и развитие эмбрионов были сравнимы с соответствующими показателями при использовании сперматозоидов без делеций [15, 21, 24]. В нашей практике имеется лишь один случай выполнения ИКСИ сперматозоидами полученными от "носителя" микроделеции (1-10). При этом перенос 3 эмбрионов, полученных после инъекции сперматозоидов в 6 зрелых ооцитов, привел к наступлению беременности. У остальных 5 пациентов сперматозоиды отсутствовали как в эякуляте, так и в тестикулярном биоптате. Супруги были информированы о невозможности достижения беременности с помощью половых клеток отцов и им была предложена программа лечения бесплодия с использованием спермы донора. Таким образом, результаты тестирования микроделеций в AZF-регионе Y-хромосомы у пациентов с различными нарушениями сперматогенеза свидетельствуют о возможности выявления еще одной малоизвестной причины бесплодия в браке, позволяют оценивать ее частоту, степень тяжести и значение для конкретной супружеской пары и ее потомства, воздержаться от попыток бесперспективного лечения нарушений репродуктивной системы мужчины и прогнозировать вероятность получения сперматозоидов. Исходя из полученных данных, можно рекомендовать определение AZF-делеций у всех бесплодных пациентов при концентрации сперматозоидов ниже 5 млн/мл. В.М. Здановский, П.А. Гоголевский, И.К. Гоголевская, Д.А. Крамеров, А.С. Тогобецкий, Л.В. Хилькевич, Д.А. Бондарев Центр по лечению бесплодия ЭКО1, Институт молекулярной биологии им. Энгельгардта2, Центр планирования семьи и репродукции3, Москва Литература 1. Голевская И.К., Гоголевский П.А. Y-хромосома и мужское бесплодие. Пробл репрод 1999; 5. 2. Brandell R.A. et al. AZFb deletions predict the absence of spermatozoa with testicular sperm extraction: preliminary report of a prognostic genetic test. Hum Reprod 1998; 13: 2812-2815. 3. Chandley A.C. and Cooke H.J. Human male fertilitY-Y linked genes and spermatogenesis. Hum Mol Genet 1994; 3: 1449-1452. 4. Edwards R.G. and Bishop C.E. On the origin and frequency of Y-chromosome deletions responsible for severe male infertility. Mol Hum Reprod 1997; 3: 549-554. 5. Foresta C. et al. Deletion and expression analysis of AZFa genes on the human Y chromosome revealed a major role for DBY in male infertility. Hum Mol Genet 2000; 9: 1161-1169. 6. Foresta С. et al. High-frequency of well-defined Y-chromosome deletions in idiopathic Sertolli cell-only syndrome. Hum Reprod 1998; 13: 2: 302-308. 7. Foresta С. et al. Y-chromosome deletions in idiopathic severe testiculopathies. J Clin Endocrinol Metab 1997; 82: 1075-1080. 8. Girardi S.K. et al. Submicroscopic deletions in the Y-chromosome of infertile men. Hum Reprod 1997; 12: 1635-1641. 9. Krausz C., McElreavey K. Y-chromosome and male infertility. Frond Biosci 1999; 15: 1-8. 10. Krausz C. et al. What is the clinical prognosric value of Y-chromosome microdeletion analysis. Lancet 2000. 11. Kent-First M.G. et al. The incidence and possible relevence of Y-linked microdeletions in babies born after ICSI and their infertile father. Mol Hum Reprod 1996; 12: 943-950. 12. Kent-First M. et al. Defining Regions of the Y-Chromosome Responsible for Male Infertility And Identification of a Forth AZF Region (AZFd) by Y-Chromosome Microdeletion Detection. Mol Reprod Develop 1999; 53: 27-41. 13. Lahn В.Т. and Page D. Functional coherence of the human Y-chromosome. Science 1998; 278: 675-680. 14. Mosher W.D. Reproductive impairements in the United States, 1965-1982. Demography 1985; 22: 415-430. 15. Mulhall J.P. et al. Azoospermic men with deletion of the DAZ gene cluster are capable of completing spermatogenesis: fertilization, normal embryonic development and pregnancy occur when retrieved testicular spermatozoa are used for intracytoplasmic sperm injection. Hum Reprod 1997; 12: 503-508. 16. Oates R.D. et al. The spectrum of spermatogenic deficiency in 20 men with Y interstitial microdeletions confined to the AZFc (DAZ) region. Poster, 16th World Congress on Fert. and Steril. (IFFS'98 - San Francisco, USA) 1998. 17.Palka G. and Dallapiccola B. Widening of a Y-chromosome interval-6 deletion transmitted from a father to his infertile son accounts for an oligozoospermia critical region distal to the RBM1 and DAZ genes. Am J Hum Genet 1996; 59: 1393-1395. 18. Pryor J.L. et al. Microdeletions in the Y chromosome of infertile men. New Eng J Med 1997; 336: 534-539. 19. Quereshi S.J. et al. PCR screening for Y chromosome microdeletions: a first step towards the diagnosis of genetically determinined spermatogenic failure in men. Mol Hum Reprod 1996; 2: 775-779. 20. Reijo R. et al. Diverse spermatogenic defects in humans caused by Y chromosom deletions encompassing a novel RNA-binding protein gene. Nature Genet 1995; 10: 383-393. 21. Rossato M. et al. High fertilization rate in conventional in vitrofertilization utilizing spermatozoa from an oligozoospermic subject presenting microdeletions of the Y chromosome long arm. Mol Hum Reprod 1998; 4: 473-476. 22. Simoni M. et al. Screening for deletions of the Y chromosome involving the DAZ (Deleted in Azoospermia) gene in azoospermia and severe oligozoospermia. Fertil Steril 1997; 67: 542. 23. Simoni M. et al. Int J Androl1999.22.292-299 Silber S.J. Pregnancies and children from ICSI using sperm of Y-deleted azoospermic and severely oligospermic men. Poster, 16th World Congress on Fert. and Steril. (IFFS'98 - San Francisco, USA) 1998. 24. Silber S.J et al. Y-chromosome deletions in azoospermic and severy oligozoospermic men undergoing intracytoplasmic sperm injection after testicular sperm extraction. Hum Reprod 1998; 13: 3332-3337. 25. Tiepolo L. and Zuffardi O. Localization of factors controlling spermatogenesis in the nonfluorescent portion of the human Y chromosome long arm. Hum Genet 1976; 34: 119-124. 26. Van der Vent K. et al. Combined cytogenetic and Y chromosome microdeletion screening in males undergoing intracytoplasmic sperm injection. Mol Hum Reprod 1997; 3: 699-704. 27. Vergnaud G. et al. A deletion map of the human Y chromosome based on DNA hybridization. Am J Hum Genet 1986; 38: 109-124. 28. Vogt P.H. et al. Human Y chromosome azoospermia factors (AZF) mapped to different subregions in Yq11. Hum Mol Genet 1996; 5: 933-943. 19. Vogt P.H. Cytogenet Cell Genet 1997; 79: 1-20. 30. Vollrath D. et al. The human Y chromosome: a 43-interval map based on naturally occuring deletions. Science 1992; 258: 52-59 |