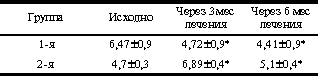Возможности применения препарата Сиофор (метформина гидрохлорида) у женщин с синдромом поликистозных
|
Синдром поликистозных яичников (СПЯ) является одной из причин бесплодия у 5-15% женщин репродуктивного возраста. СПЯ характеризуется хронической гиперандрогенической ановуляцией. У женщин с СПЯ в сочетании с ожирением диагностические критерии, отражающие степень выраженности менструальных нарушений, больше связаны с имеющейся инсулинорезистентностью (прогрессирующее ожирение, гиперинсулинемия натощак, нарушение толерантности к глюкозе - НТГ), чем с нарушенной секрецией гонадотропинов или морфологическими изменениями в яичниках. По данным разных авторов, 51-60% женщин репродуктивного возраста с установленным диагнозом СПЯ имеют избыточную массу тела [1-3, 13]. Более того, у 40% женщин в возрасте старше 40 лет с СПЯ имеется нарушение толерантности к углеводам или сахарный диабет II типа [13].
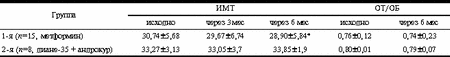
Несмотря на то, что основной патофизиологический дефект СПЯ еще не определен, у половины больных с этим заболеванием выявляется инсулинорезистентность, а избыточная масса тела еще больше усиливает это состояние [9]. Инсулинорезистентность представляет собой основной патофизиологический механизм, лежащий в основе развития метаболического синдрома, именуемого также синдромом Х (инсулинорезистентность в сочетании с ожирением, сахарным диабетом II типа или НТГ, эссенциальной гипертензией, дислипидемией). У больных с инсулинорезистентностью может наблюдаться гиперинсулинемия в сочетании с нормогликемией или с гипергликемией, нарушение инсулинзависимой утилизации глюкозы тканями. Гиперинсулинемия (основное проявление инсулинорезистентности) рассматривается как независимый фактор риска сердечной недостаточности, атеросклероза, ожирения и СПЯ у женщин репродуктивного и пременопаузального возраста. Изолированное повышение уровня андрогенов в сыворотке крови может вызывать незначительную инсулинорезистентность [15]. Однако инсулинорезистентность при СПЯ не всегда можно считать результатом гиперандрогении. По данным некоторых авторов, инсулинорезистентность может персистировать у женщин, принимавших агонисты гонадотропин-рилизинг-гормонов с целью подавления секреции андрогенов яичниками, а также у больных с acantosis nigricans, несмотря на то, что гиперандрогении может и не быть в течение ряда лет после выявления инсулинорезистентности [14]. У женщин с точечными мутациями гена рецепторов к инсулину и гиперинсулинемической инсулинорезистентностью в 60% случаев выявляется СПЯ [11]. Существует еще одна форма инсулинорезистентности при СПЯ, которая является уникальной и механизм которой до сих пор не выяснен [4, 6, 8]. Это форма - «СПЯ-специфическая» инсулинорезистентность, встречаемая у женщин с СПЯ в сочетании с ожирением ("PCOS-specific" insulin resistance). «СПЯ-специфическая» форма инсулинорезистентности, скорее всего, связана не с патологией самого инсулина и не с количеством или аффинностью инсулиновых рецепторов в тканях-мишенях, а с «поломками» на пострецепторном уровне. Именно сериновое фосфорилирование у человека энзима Р450с17a, являющегося ключевым звеном в биосинтезе андрогенов, повышает активность 17,20-лиазы. А генетический дефект, который способствует усилению серинового фосфорилирования, может объяснять как инсулинорезистентность, так и гиперандрогению при СПЯ. Однако у большинства женщин с СПЯ дефект фосфорилирования отсутствует, и способность инсулина стимулировать секрецию андрогенов яичниками до сих пор не ясна [6]. Поэтому комплексное консервативное лечение СПЯ должно предусматривать не только использование современных антиандрогенных, гестагенных препаратов, индукторов «стимуляции овуляции», но и более широкое применение препаратов, влияющих на инсулинорезистентность. К таким препаратам относятся бигуаниды. В настоящее время единственным используемым препаратом этой группы является метформин. Метформин используется с 1957 г. для терапии больных сахарным диабетом II типа и с избыточной массой. Он дает значительный антигипергликемический эффект и благоприятно влияет на показатели липидов в сыворотке крови: снижает уровень общего холестерина, ЛПНП (липопротеины низкой плотности) фракции холестерина и уровень триглицеридов. Во многих исследованиях показано, что при терапии метформином снижается масса тела [7]. Патофизиологические механизмы, лежащие в основе сахаропонижающего действия препарата, не опосредованы секрецией инсулина и включают супрессию секреции глюкозы печенью, увеличение периферической утилизации глюкозы и увеличение потребления глюкозы в кишечнике. Цель исследования Изучение возможности коррекции инсулинорезистентности у женщин с СПЯ и избыточной массой тела на фоне приема метформина. Материал и методы Обследованы 23 женщины репродуктивного возраста с установленным диагнозом СПЯ и избыточной массой тела: 18 (78,2%) - с нормальной толерантностью к углеводам, 5 (21,8%) - с НТГ. Все обследованные женщины были разделены на две группы: женщины 1-й группы (n=15, из них 5 - с НТГ) получали метформина гидрохлорид (сиофор, «Берлин-Хеми», Германия) в дозе 1000 мг/сут (500 мг в таблетке, по 1 таблетке 2 раза в день), в течение 6 мес. Возраст обследуемых колебался от 24 до 32 лет (в среднем составлял 28,1±4,1 года). Женщины 2-й контрольной группы (n=8) получали препарат диане-35 (ципротерона ацетат 2 мг и этинилэстрадиола 35 мкг; «Шеринг», Германия) с 5-го по 25-й день менструального цикла по 1 таблетке на ночь в сочетании с андрокуром 25 мг («Шеринг», Германия) с 5-го по 14-й день менструального цикла в течение 6 мес. Возраст женщин этой группы составил 24-31 год (в среднем - 27,3±3,7 года). Ни одна из женщин по поводу СПЯ не лечилась. Верификация диагноза СПЯ включала изучение анамнестических данных (постепенное развитие заболевания с периода менархе); клинической симптоматики (нарушения менструального цикла по типу олиго- и/или опсоменореи, вторичной аменореи с периода менархе и не имеющей тенденции к самостоятельной нормализации; наличие первичного бесплодия, носящего ановуляторный характер, подтвержденное графиками базальной температуры в течение 3-4 мес, наличие избыточной массы тела, соответствующей II-III степени ожирения, общий осмотр больных (наличие гирсутизма различной степени выраженности, acnae vulgaris). Диагноз СПЯ подтверждался результатами УЗИ органов малого таза с использованием трансвагинального датчика (объем яичников более 9 см за счет гиперплазированной стромы, наличие множественных атретичных фолликулов диаметром 6-9 мм): повышенное содержание в плазме крови ЛГ; соотношение ЛГ/ФСГ і2,5, увеличение в плазме крови содержания свободного тестостерона (Т) при нормальных значениях дегидроэпиандростерона сульфата (ДЭА-С) и 17-оксипрогестерона. В ходе исследования у всех женщин (n=23) определяли индекс массы тела (ИМТ), отношение объема талии к объему бедер (ОТ/ОБ), проводили пероральный глюкозотолерантный тест (ПГТТ; 75 г глюкозы), исследовали иммунореактивный инсулин (ИРИ), С-пептид, общий холестерин, фракции ЛПНП, липопротеинов высокой плотности (ЛПВП), триглицериды, уровень секссвязывающего глобулина (ССГ). Уровень ИРИ и С-пептида определяли методом ИРМА с использованием наборов «Иммунотех» (Франция, Чехия). Резистентность к инсулину выявляли методом оценки «минимальной модели» гомеостаза с определением HOMA (Homeostasis Model Assessment) [13]. Проводили УЗИ печени и надпочечников. Уровень ЛГ, ФСГ, свободного Т, ДЭА-С исследовали либо на 5, 6, 7-й день менструального цикла, либо на 45-й день менструального цикла при его нарушениях. Композиционный состав тела определяли методом двуэнергетической рентгеновской абсорбциометрии на аппарате «Эксперт XL» («Лунар»,США). Полученные данные оценивались исходно, через 3 и 6 мес на фоне лечения. Статистическая обработка данных производилась с использованием вариационных статистических программ Майкрософт (Эксель). Результаты Показатели ИМТ, отношения ОТ/ОБ исходные и на фоне терапии у женщин в обеих группах представлены в табл. 1. Как видно из табл. 1, в группе больных, принимавших метформин в течение 6 мес, достоверно снизились показатели ИМТ (в среднем на 6%), что соответствовало снижению массы тела на 5-11 кг (в среднем на 8,4±1,3 кг). Отношение ОТ/ОБ не изменилось. Во 2-й группе (диане в сочетании с андрокуром 25 мг) масса тела снизилась на 2-5 кг (в среднем на 3,8±0,6 кг); а ИМТ и отношение ОТ/ОБ не изменились. Таким образом, снижение массы тела в группе женщин, получавших метформин, было более выраженным, чем в группе сравнения. Таблица 1. Динамика показателей ИМТ, ОТ/ОБ на фоне терапии
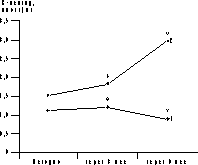
* p<0,05 (здесь и в табл. 2-4). Динамика уровня гликемии и ИРИ представлена на рис. 1 и 2. В ходе ПГТТ в группе женщин, принимавших метформин, уровень С-пептида достоверно снизился с 1,12±0,97 до 0,86±0,12 пмоль/мл (p<0,05). У больных, находившихся на антиандрогенной терапии, уровень С-пептида повысился с 1,51±0,58 до 1,82±0,14 и 3,0±0,8 пмоль/мл соответственно (p<0,05, рис. 2). Оценка резистентности к инсулину, определяемая показателем HOMA-R, представлена в табл. 2. Исходно у больных 1-й группы отмечены базальная гиперинсулинемия (30,06±2,6 мЕД/мл, при норме до 25 мЕД/мл) и стойкий гиперинсулинизм после стимуляции глюкозой (динамика уровня ИРИ при ПГТТ через 0, 30, 60 и 120 мин - 30,06±2,6, 59,5±23,8, 130,3±52,8 и 47,8±24,6 мЕД/мл). Это, по-видимому, связано с гиперсекрецией инсулина поджелудочной железой, которая позволяет поддерживать нормальную толерантность к углеводам на фоне имеющейся инсулинорезистентности (см. рис. 2, а). В 1-й группе больных, получавших метформин, отмечено достоверное снижение уровня гликемии в ходе ПГТТ на 60-й и 120-й минутах к концу 3-го месяца лечения (динамика гликемии в ходе ПГТТ на 60-й минуте составила 6,95±1,85 ммоль/л исходно, 6,27±3,33 ммоль/л через 3 мес и 6,2±3,01 ммоль/л через 6 мес (p<0,05) - снижение на 10%; на 120-й минуте - соответственно 6,21±1,29, 5,06±2,44 и 4,29±2,1 ммоль/л (p<0,05) - снижение на 31%). Во 2-й группе больных динамика гликемии в ходе ПГТТ была менее значимой (на 60-й мин - 8,39±1,01 ммоль/л исходно, 7,64±1,76 ммоль/л через 3 мес, 6,8±0,4 ммоль/л через 6 мес на фоне лечения (p<0,05) - снижение на 19%; на 120-й минуте - соответственно 6,37±1,43, 6,11±1,45 и 6,8±1,27 ммоль/л). Что касается динамики уровня ИРИ, то также отмечено его достоверное снижение (30,06±2,6 мЕД/л исходно; 20,08±11,56 мЕД/л через 3 мес, 19,4±15,16 мЕД/л через 6 мес на фоне лечения, p<0,05). Анализ динамики уровня С-пептида в группе женщин, принимавших метформин, также выявил его достоверное снижение (с 1,12±0,97 до 0,86±0,12 пмоль/мл, p<0,05); (см. рис. 2, а). Сочетанное снижение уровня гликемии и инсулинемии может свидетельствовать об уменьшении инсулинорезистентности. Это подтверждалось показателями HOMA-R, который достоверно снизился при терапии только в 1-й группе больных. Однако до начала обследования в сравниваемых группах больных отмечались различные значения HOMA-R (в 1-й группе - 6,47±0,9; во 2-й группе - 4,7±0,3), это обусловлено тем, что в 1-ю группу входили женщины с НТГ.
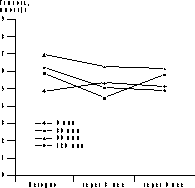
Рис. 1. Динамика уровня глюкозы в ходе лечения метформином (а) и диане + андрокуром (б).
Таблица 2.Оценка резистентности к инсулину (НОМА-R) у больных СПЯ
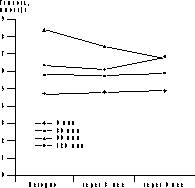
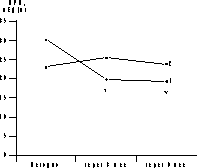
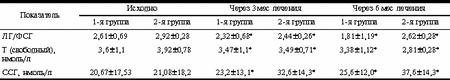
Рис. 2. Динамика уровней базального ИРИ (а) и С-пептида (б) в 1-й и 2-й группах. Таблица 3. Динамика ЛГ/ФСГ, свободного Т и ССГ на фоне лечения СПЯ
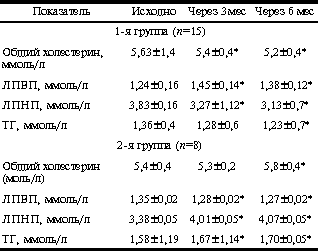
Таблица 4.Динамика уровня холестерина и ТГ на фоне лечения СПЯ снижению (p<0,01).
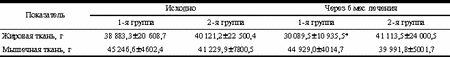
У больных 1-й группы отмечено достоверное снижение показателя HOMA-R на 27% через 3 мес и на 32% через 6 мес терапии. Во 2-й группе больных отмечено достоверное увеличение показателя HOMA-R к 3-му месяцу терапии (с 4,7±0,3 до 6,89±0,4; p<0,05), а затем его снижение (до 5,1±0,4; p<0,05). Однако показатель HOMA-R через 6 мес лечения статистически оказался выше в сравнении с исходными значениями (5,1±0,4 против 4,7±0,3; p<0,05, см. табл. 2). В табл. 3 приведены данные, отражающие динамику отношения ЛГ/ФСГ, уровня Т и ССГ в ходе терапии в обследуемых группах женщин. Анализ данных табл. 3 показывает, что на фоне проводимой терапии к концу 3-го месяца лечения отношение ЛГ/ФСГ достоверно снизилось в обеих обследуемых группах. При этом в 1-й группе отношение ЛГ/ФСГ к концу 6-го месяца терапии стало соответствовать нормативным показателям. Во 2-й группе отношение ЛГ/ФСГ также снизилось к 6-му месяцу лечения при сравнении с исходными данными, однако в меньшей степени, чем в 1-й группе. Снижение уровня свободного Т в сыворотке крови было более значительным во 2-й группе женщин и составило в среднем 28%. Повышение уровня ССГ было также более явным в группе больных, получавших антиандрогенную терапию (78%). Изменения липидного спектра крови исходно, через 3 и 6 мес терапии представлены в табл. 4. Как видно из табл. 4, в 1-й группе больных отмечено достоверное снижение уровня общего холестерина в среднем на 8% (p<0,01), в отличие от 2-й группы, где выявлялось достоверное увеличение уровня общего холестерина через 6 мес в среднем на 7% (p<0,01). Уровень ЛПВП в 1-й группе женщин увеличился (p<0,01), во 2-й - отмечена тенденция к его снижению (р меньше 0,01). Уровень ЛПНП в группе больных, принимавших сиофор, снизился через 6 мес терапии (p<0,05) на 18%. Во 2-й группе женщин динамика уровня ЛПНП была полностью противоположной, и данный показатель имел тенденцию к повышению (p<0,05). Динамика уровня ТГ аналогична таковой показателя ЛПНП в данной группе больных. Среди женщин 1-й группы (n=23) синдром хронической ановуляции выявлялся у 19 (83%), нарушения менструального цикла по типу полименореи с верифицированной при УЗИ органов малого таза гиперплазией эндометрия - у 2 (9%), гиполютеинизм - у 1 (4%) больной. Фиброзно-кистозная мастопатия (диффузная форма, подтвержденная маммографией и данными УЗИ) отмечена у 20 (87%) больных. Жалобы на первичное бесплодие предъявляли 19 (83%) женщин; 1 (4%) женщина имела в анамнезе самопроизвольное прерывание беременности в срок 3-4 нед. Больным рекомендовалось в период лечения использование механических средств контрацепции. Однако отдельные пациентки не следовали данным рекомендациям. На фоне лечения метформином к концу 3-го мес лечения у 3 (20%) больных наступила маточная беременность, причем у одной - двойней, в связи с чем прием препарата был прекращен. 3 (20%) больных к началу 3-го мес лечения предъявили жалобы на сыпь в области лица (n=2) и в области кистей рук (n=1). Прием метформина был временно прекращен и назначены антигистаминные препараты. Однако одна пациентка самостоятельно продолжила лечение метформином в прежней дозе (1000 мг/сут). У этой больной было отмечено исчезновение сыпи через 3 нед после повторного возникновения. Следует отметить, что в те же сроки у нее была выявлена пигментация в области грудины по типу acantosis nigricans. К концу 6-го мес лечения у 6 (60%) женщин 1-й группы отмечен овуляторный менструальный цикл, но с гиполютеиновым компонентом. Динамика объема яичников и М-эха в обследуемых группах представлена в табл. 5. На фоне терапии объем яичников достоверно уменьшился у женщин обеих групп, однако у женщин 2-й группы в гораздо большей степени (объем правого яичника - на 38%, левого яичника - на 43%). Анализ показателя М-эхо у женщин обеих групп не выявил статистически достоверных изменений. Данные о композиционном составе тела при проведении двуэнергетической рентгеновской абсорбциометрии на аппарате Эксперт XL с использованием программы анализа композиционного состава тела представлены в табл. 6. Таблица 5.Динамика объема яичников и толщины эндометрия в ходе лечения СПЯ
* p<0,01. У обследованных женщин с СПЯ и избыточной массой тела количество жировой ткани было сопоставимо с количеством мышечной ткани и средние коэффициенты отношения ОТ/ОБ были более 0,80, что свидетельствует о преимущественно кушингоидном типе ожирения у данных больных. В группе больных, принимавших метформин, было отмечено достоверное уменьшение количества жировой ткани в среднем на 23%. В группе больных, принимавших диане-35 в сочетании с андрокуром, количество жировой и мышечной массы статистически не изменилось. Однако данные оказались статистически недостоверны. Обсуждение Как правило, пациентки с СПЯ обращаются к врачу с жалобами на бесплодие. Поэтому целью лечения является восстановление овуляторных циклов. При СПЯ в сочетании с избыточной или нормальной массой тела последовательность терапевтических мер различается [1]. Однако очень часто практикующие гинекологи при верификации диагноза СПЯ в сочетании с избыточной массой тела рекомендуют одновременное использование антиандрогенного лечения препаратами диане-35 и/или андрокур в течение 6-8 мес и соблюдение гипокалорийной диеты. Как отмечено выше, среди женщин с СПЯ и ожирением 80-90% являются инсулинорезистентными, а 40-60% уже имеют НТГ [13]. Немаловажно и то, что прогестагеновый компонент (ципротерона ацетат), входящий в состав диане-35, неблагоприятно влияет на углеводный обмен, способствуя развитию инсулинорезистентности. Поэтому медикаментозная терапия метаболических нарушений у данной категории больных является важнейшим компонентом в лечении. В настоящее время наиболее распространенным препаратом, оказывающим влияние на инсулинорезистентность, является метформина гидрохлорид. Одним из механизмов действия метформина является усиление утилизации глюкозы в мышечной ткани за счет снижения периферической инсулинорезистентности. В России метформин представлен препаратом сиофор («Берлин-Хеми», Германия). Кроме основного механизма действия, метформин тормозит печеночный глюконеогенез, снижает скорость резорбции глюкозы в тонкой кишке и подавляет аппетит [2]. К другой группе препаратов, влияющих на инсулинорезистентность, относятся тиазолидиндионы. Однако опыта применения препаратов этой группы в России пока нет. Кроме того, указанные средства не влияют на ИМТ. Учитывая наличие инсулинорезистентности при СПЯ, можно предположить, что назначение метформина могло бы оказать значительное влияние на течение заболевания. Механизм действия метформина при СПЯ и избыточной массе тела до конца не ясен. Предполагается, что снижение влияния инсулина на яичники, за счет уменьшения ими секреции андрогенов и влияния на печень (повышение уровня глобулинов, связывающих половые стероиды), оказывает позитивное влияние и приводит к клиническому улучшению. Анализ данных литературы показывает, что снижение содержания инсулина в сыворотке крови с сопутствующим улучшением инсулинорезистентности, сопровождается снижением активности яичникового энзима P450с17a и соответственно андрогенов. Это относится к группе женщин как с ожирением и СПЯ, так и без избыточной массы тела. Степень гиперандрогении при СПЯ может быть значительно снижена при уменьшении уровня инсулина в сыворотке крови [13]. Терапия метформином в дозе 500 мг 2 раза в сутки в течение 3-6 мес снижает уровень инсулина натощак и после стимуляции глюкозой. Снижение гиперинсулинемии при приеме метформина, вероятно, и приводит к уменьшению активности P450с17a, а также к снижению базальной и стимулированной секреции ЛГ, содержания свободного Т в сыворотке крови и повышению уровня ССГ. По нашему мнению, это связано с тем, что гиперинсулинемия увеличивает активность P450с17a у женщин с избыточной массой тела за счет прямой стимуляции яичникового стероидогенеза и/или непрямой стимуляции секреции гонадотропных гормонов. Однако, по данным некоторых авторов, не отмечено значительного снижения уровня андрогенов и инсулина в плазме крови после терапии метформином у женщин с чрезмерно выраженным ожирением и СПЯ. Возможно, это связано с большой выраженностью метаболических нарушений при резковыраженном ожирении (средний показатель ИМТ составил 40). Тем не менее восстановление менструального цикла вскоре после начала терапии метформином отмечено у значительного числа больных с СПЯ. Таблица 6. Композиционный состав тела в группах женщин с СПЯ
* p<0,001. Анализируя полученные данные, можно предположить, что прием метформина способствует снижению уровня свободных андрогенов, приводя к восстановлению нормального менструального цикла, что согласуется с данными зарубежных исследований [11]. Уровень инсулина у обследованных нами больных положительно коррелирует с уровнем Т. Изучение влияния метформина на спонтанную и индуцированную кломифеном овуляцию при СПЯ показало, что влияние кломифена на овуляцию повышается у женщин с СПЯ в сочетании с ожирением только при снижении уровня инсулина [7, 12]. При резистентности к кломифену и гонадотропным гормонам терапия метформином на фоне снижения секреции яичниковых андрогенов и эстрадиола улучшает ответную овуляторную реакцию на их введение у большинства больных [5]. В нашем исследовании при назначении метформина женщинам с СПЯ, у которых была выражена гиперинсулинемия натощак, восстановление нормального менструального цикла происходило у 60% вне зависимости от предшествовавшей массы тела. При наличии избыточной массы тела достоверно отмечалось ее снижение. Кроме того, по данным зарубежной литературы, терапия метформином также приводит к снижению концентрации лептина в сыворотке крови у женщин с СПЯ в сочетании с избыточной массой тела, что также является патогенетическим обоснованием к использованию данного препарата [10]. У женщин с СПЯ наиболее часто встречается ожирение по кушингоидному типу, в отличие от больных с алиментарными формами, при которых количество жировой ткани может в 2-3 раза превышать количество мышечной. По нашим данным, терапия сиофором приводит к значительному снижению количества жировой ткани, что оказывает положительное влияние на выраженность инсулинорезистентности. Уменьшение содержания жира в мышечной ткани, выявленное в ходе нашего исследования, возможно, улучшает процесс инсулинзависимой утилизации глюкозы в скелетных мышцах, оказывая положительное влияние на инсулинорезистентность, что подтверждается снижением показателя HOMA-R. В нашем исследовании отмечалось снижение количества жировой ткани параллельно снижению показателя HOMA-R, что свидетельствовало о коррекции инсулинорезистентности в обследованной группе женщин. У 4 женщин к 3-му мес приема препарата сиофор появилась мелкопапуллезная сыпь в области лица и кистей рук. У данных больных после консультации дерматолога был верифицирован диагноз атопического дерматита. Следует подчеркнуть, что данное заболевание кожи имеет в своей основе врожденные аномалии обмена веществ. К таким нарушениям можно отнести агистидинизацию, приводящую к общей сенсибилизации, и агаммаглобулинемию, протекающую с уменьшением количества циркулирующих Т-лимфоцитов, снижением уровня IgA и IgM при увеличении уровня IgG и IgE. Это способствует поддержанию на коже инфекционных и аллергических проявлений. Аcnae vulgaris, характерное для СПЯ, еще больше усугубляет клиническую картину. Помимо этого, атопический дерматит, начинаясь в раннем детском возрасте с проявлений экссудативного диатеза и пройдя экзематозную стадию, приобретает хронический характер. Естественно, что любое нарушение гомеостаза в организме, обусловленное внешними или внутренними факторами, может привести к обострению хронического процесса. Также есть данные, что в патогенезе атопического дерматита играют роль наследственные факторы, а само заболевание генетически детерминировано. Примечательно, что у одной больной при самостоятельном продолжении приема сиофора на фоне атопического дерматита проявился acantosis nigricans. Это может расцениваться как подтверждение генетической сцепленности атопических заболеваний с СПЯ. Недавно были опубликованы данные о том, что на фоне терапии инсулиновыми сенситайзерами и снижения уровня инсулина отмечается ремиссия псориаза, также являющегося аутоиммунным заболеванием. Высказано предположение о том, что активируемый пролифератом пероксисом рецептор-гамма экспрессируется в человеческих кератоцитах, а при приеме сенситайзеров инсулина блокируется рост нормальных и псориатических кератоцитов. Также предполагается, что при снижении уровня инсулина ингибируется реактивность иммунной системы, что приводит к ремиссии аутоиммунных заболеваний, в том числе с кожными проявлениями. В дальнейших исследованиях мы планируем изучить состояние иммунного статуса у женщин с СПЯ в сочетании с избыточной массой тела более подробно. Наши данные подтверждают предположения о том, что гиперинсулинемия при СПЯ является причиной гиперандрогении, а инсулинорезистентность играет одну из ведущих ролей в патогенезе СПЯ [3]. В последнее время появились исследования, в которых предполагается наличие гена, обусловливающего наследственную предрасположенность к стимулирующему влиянию инсулина на яичниковые андрогены. Считается, что локус гена, возможно отвечающего за предрасположенность к СПЯ, располагается около гена инсулиновых рецепторов на хромосоме 19. Генетические исследования, проведенные у 172 женщин в пременопаузе, у 50% которых был СПЯ, а 50% - такового не имели, показали, что генный микросателлитный маркер D19S884 ассоциируется именно с развитием СПЯ. Этот маркер не является мутацией и в настоящее время является объектом пристального изучения. Современная сахаропонижающая терапия с использованием препаратов, влияющих на инсулинорезистентность, способствует коррекции многих нарушений, входящих в понятие «метаболический синдром». Коррекция вышеуказанных патологических состояний, начиная уже с пубертатного периода, способствует улучшению «качества жизни» больных. Данная проблема требует дальнейшего изучения с проведением проспективных, рандомизированных исследований. Выводы 1. У 60% женщин с СПЯ в сочетании с избыточной массой тела выявляется базальная и стимулированная гиперинсулинемия, а у 20% - нарушенная толерантность к углеводам. 2. На фоне приема метформина (сиофор) у данной категории больных уже к третьему месяцу терапии отмечается снижение уровня гликемии, инсулина, HOMA-R, свидетельствующее об уменьшении инсулинорезистентности. 3. Терапия метформином у женщин с СПЯ и избыточной массой тела в течение 6 мес снижает инсулинорезистентность, нормализует массу тела за счет уменьшения преимущественно жировой ткани, тем самым восстанавливая менструальный цикл примерно у 60% больных и повышая коэффициент фертильности на 20%. М.Б. Анциферов, О.Р. Григорян, Т.О. Чернова Эндокринологический научный центр РАМН, Москва Литература 1. Манухин И.Б., Геворкян М.А. Синдром поликистозных яичников (Клиническая лекция). Пробл репрод 1999; 5: 6: 13-19. 2. Анциферов М.Б. Исследование UKPDS и основные принципы пероральной терапии сахарного диабета II типа, монография «Ожирение. Метаболический синдром. Сахарный диабет II типа». Под ред акад. РАМН И.И. Дедова. М 2000; 53-61. 3. Apter D., Butzow T., Laughlin G.A., Yen S.S. Metabolic features of polycystic ovary syndrome are found in adolescent girls with hyperandrogenism. J Clin Endocrinol Metab 1995; 80: 2966-2973. 4. Ciaraldi T.P., el Roeiy A., Madar Z., Reinchart D., Olefsky J.M., Yen S.S.C. Cellular mechanisms of insulin resistance in polycystic ovarian syndrome. J Clin Endocrinol Metab 1992; 75: 577-583. 5. De Leo V., La Marca A., Ditto A., Morgante G., Cianci A. Effects of metformin on gonadotropin-induced ovulation in women with polycystic ovary syndrome. Fertil Steril 1999; Aug 72: 2: 282-5. 6. Dunaif A., Xia J., Book C.B., Schenker E., Tang Z. Exessive insulin receptor serine phosphorylation in cultured fibroblasts and in skeletal muscle. A potential mechanism for insulin resistance in polycystic ovary syndrome. J Clin Invest 1995; 96: 801-810. 7. Glueck C.J., Wang P., Fontaine R., Tracy T., Sieve-Smith L. Metformin-induced resumption of normal menses in 39 of 43 (91%) previously amenorrheic women with polycystic ovary syndrome. Metabolism 1999; Apr 48: 4: 511-9. 8. Jananfar S., Eden J.A., Warren P., Seppala M., Nguyen T.V. A twin study of polycystic ovary syndrome. Fertil Steril 1995; 478-486. 9. Legro R.S. Polycystic ovary syndrome: current and future treatment paradigms. Am J Obstet Gynecol 1998; Dec 179: 6: 2: S101-S108. 10. Morin-Papunen L.C., Koivunen R.M., Tomas C., Ruokonen A., Martikainen H.K. Decreased serum leptin concentrations during metformin therapy in obese women with polycystic ovary syndrome. J Clin Endocrinol Metab 1998; Jul 83: 7: 2566-8. 11. Moller D.E., Flier J.S. Detection of an alteration in the insulin resistance, acantosis nigricans, and the polycystic ovary syndrome (Type A insulin resistance). N Engl J 1988; 319: 1526-1529. 12. Nestler J.E., Jakubowicz D.J., Evans W.S., Pasquali R. Effects of metformin on spontaneous and clomiphene-induced ovulation in the polycystic ovary syndrome. N Engl J Med 1998; Jun 25: 338: 26: 1876-80. 13. Reaven G.M., Laws A. Insulin Resistance. The Metabolic Syndrome X. HUMANA PRESS 1999; 373. 14. Richards G.E., Cavallo A., Meyer W.J. III, Prince M.J., Peters E.J., Stuard C.A., Smith E.R. Obesity, acantosis nigricans, insulin resistance, and hyperandrogenia: pediatric perspective and natural history. J Pediatr 1985; 107: 893-897. 15. Speiser P.W., Serrat J., New M.I., Gertner J.M. Insulin insensitivity in adrenal hyperplasia due to nonclassical steroid 21-hydroxylase deficiency. J Clin Endocrinol Metab 1992; 75: 1421-1424.
Врач: - Ваши ноги в порядке. Они чернеют, потому что вы их давно не мыли. - Большое спасибо, доктор. Мой врач сказал то же самое. Но я всегда советуюсь со столичным специалистом перед тем, как предпринять что-то радикальное. |