Влияние заместительной гормональной терапии препаратом Фемостон
|
Метаболические нарушения, возникающие на фоне дефицита половых гормонов, в последние годы принято называть "менопаузальным метаболическим синдромом" (ММС). Основные его проявления - прибавка массы тела после менопаузы с формированием абдоминального ожирения, инсулинорезистентность и гиперинсулинемия [1]. Кроме того, при ММС часто отмечается дислипопротеидемия, повышенное содержания факторов тромбообразования в крови и нарушение функции эндотелия [1, 2]. Все эти изменения являются звеньями патогенеза атеросклероза и приводят в конечном итоге к сердечно-сосудистым заболеваниям, а ЗГТ способствует снижению риска таких заболеваний на 30-50% [3, 4]. На четверть защитное влияние ЗГТ обусловлено изменениями липидного обмена, а в остальном - иными механизмами [5].
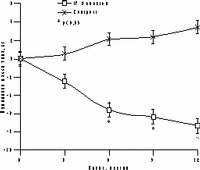
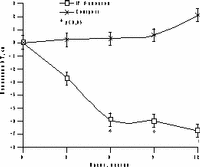
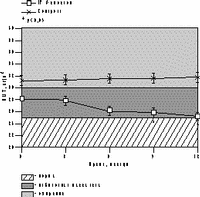
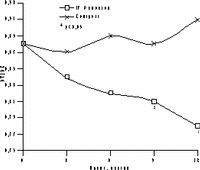
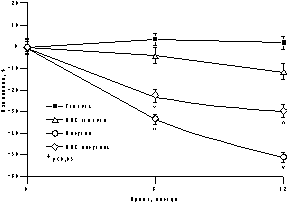
К настоящему времени из них наименее изучены изменения массы тела, характер распределения жира и углеводного обмена. По статистике у женщин ожирение встречается чаще, чем у мужчин, причем с возрастом прогрессирует вследствие замедления скорости метаболизма после менопаузы [6]. Быстрая прибавка массы тела в перименопаузе фиксируется примерно у 60% женщин [7]. Фактором риска сердечно-сосудистых заболеваний является абдоминальное ожирение, что объясняется специфическими анатомо-физиологическими свойствами жировой ткани абдоминально-висцеральной области: развитым кровоснабжением и высокой активностью метаболических процессов [8]. Интенсивный липолиз в абдоминально-висцеральной жировой ткани приводит к увеличению содержания свободных жирных кислот в системном кровотоке, из-за чего возникают инсулинорезистентность (снижение чувствительности тканей к инсулину) и гиперинсулинемия - независимые факторы риска развития сердечно-сосудистых заболеваний [8]. Установлено, что в постменопаузе происходит постепенное снижение секреции инсулина поджелудочной железой, что компенсируется повышением периода полураспада инсулина, то есть растут уровни инсулина в крови [9]. В полном объеме характер патогенетических взаимодействий при менопаузальном метаболическом синдроме пока не изучен, но определен главный этиологический фактор в возникновении всех обменных нарушений - снижение уровня половых гормонов; выявлено и основное связующее звено патогенеза при ММС - инсулинорезистентность, которая сочетается с абдоминальным ожирением [1, 9]. Патофизиологические механизмы такой тесной взаимосвязи заключаются в изменении при ожирении функции тканей (прежде всего жировой и мышечной), где расположены рецепторы к инсулину. Сегодня практически нет данных об изменении массы тела и характера распределения жировой ткани на фоне дефицита половых гормонов. Недостаточно изучено влияние различных режимов ЗГТ на углеводный обмен у женщин с выраженным ожирением после менопаузы. Изменения массы тела в климактерии и под влиянием ЗГТ также подробно не описаны. Поэтому мы поставили целью нашего исследования - оценить влияние ЗГТ на массу тела, характер распределения жира и углеводный обмен у женщин в перименопаузе. Материал и методы Обследовано 25 пациенток в перименопаузе в возрасте от 43 до 52 лет (средний - 48,2±2,9 лет) с нормальной массой тела до менопаузы с последующим формированием ожирения. В группе обследованных прибавка массы тела после менопаузы в среднем составила 7,6±3 кг (5-15 кг). Критерии исключения из исследования: сахарный диабет, болезнь Кушинга, гипер- или гипотиреоз, прием препаратов, влияющих на углеводный или жировой обмен, а также абсолютные противопоказания к ЗГТ. В контрольную группу включены 10 пациенток с ММС, которые отказались принимать ЗГТ. В течение года участницы исследования принимали циклический, комбинированный препарат Фемостон, в каждой упаковке которого 28 таблеток, из них первые 14 с 2 мг 17b-эстрадиола, а последние - с комбинацией 2 мг 17b-эстрадиола и 10 мг дидрогестерона. Перед назначением ЗГТ всем женщинам проведено УЗИ малого таза, маммография и цитологическое исследование цервикальных мазков. Оценка антропометрических параметров (индекс массы тела — ИМТ, объем талии — ОТ, отношение объема талии к объему бедер — ОТ/ОБ) проводилась исходно и через каждые 3 мес на фоне приема Фемостона. Основные показатели углеводного обмена анализировались исходно, через 6 и 12 мес, по данным 2-часового орального глюкозотолерантного теста с 75 г глюкозы в комбинированной фазе лечения. При этом оценивались базальные уровни глюкозы и инсулина, толерантность к глюкозе, а также суммарная ответная реакция инсулина на глюкозную нагрузку по площади под кривой (ППК) "концентрация время". Результаты При первичном обследовании избыточная масса тела (ИМТ>25 кг/м) установлена у 12 (48%), ожирение (ИМТ>25 кг/м) - у 13 (52%) больных. У всех женщин выявлен абдоминальный тип ожирения (ОТ/ОБ>0,8). Гиперинсулинемия зафиксирована у 23 (92%), нарушение толерантности к глюкозе - у 3 (12%) пациенток. Достоверное снижение массы тела установлено уже через 6 мес терапии в среднем на 4,2±0,9 кг, а через год в среднем на 6,2±0,9 кг (рис. 1). Потеря массы тела происходила за счет уменьшения количества абдоминального жира, о чем свидетельствовали значительные изменения ОТ (на 6,2±0,5 см) и отношения ОТ/ОБ (с 0,88 до 0,78) через год терапии. ИМТ к концу года лечения достиг верхней границы нормы (рис. 1). В контрольной группе антропометрические показатели увеличились. Изменения углеводного обмена на фоне Фемостона заключались в выраженном снижении базальных уровней инсулина и инсулинорезистентности (в среднем на 51,3% и 29,8%, соответственно) при стабильных показателях толерантности к глюкозе (рис. 2). В контрольной группе уровни глюкозы натощак не изменились, а базальные уровни и ППК инсулина возросли.
а — масса тела; б — ИМТ; в — ОТ; г — ОТ/ОБ.
Рис. 2.Динамика показателей углеводного обмена на фоне Фемостона. Обсуждение Полученные на фоне Фемостона результаты об изменении массы тела, существенно отличаются от данных других исследований, в которых сообщается лишь о незначительном уменьшении массы тела [10, 11]. Это объясняется тем, что в нашем исследовании участвовали пациентки со значительной прибавкой массы тела после менопаузы, а в литературе приводятся сведения об изменении массы тела на фоне ЗГТ у женщин с нормальным весом либо со значительным разбросом его значений по группе обследуемых. Падение базальных уровней инсулина и инсулинорезистентности под влиянием Фемостона сочеталось с достоверным снижением массы тела и степени абдоминального ожирения. Поскольку метаболические нарушения могут быть полностью обратимы при нормализации массы тела, не исключено, что улучшение углеводного обмена обусловлено дополнительным (помимо эффекта ЗГТ) влиянием потери массы тела, а также небольшой продолжительностью периода дефицита эстрогенов (и обменных нарушений, соответственно) у женщин в перименопаузе [11]. Заключение В целом результаты исследования показали, что менопаузальный метаболический синдром не всегда является поздним осложнением менопаузы, а может развиваться в перименопаузе, когда в клинической картине доминируют нейровегетативные симптомы климактерия. ЗГТ можно считать этиопатогенетическим методом лечения менопаузального метаболического синдрома, поскольку она способствует уменьшению степени абдоминального ожирения и нормализации углеводного обмена. Фемостон, содержащий натуральный 17b-эстрадиол и производное прогестерона - дидрогестерон, является эффективным методом коррекции ММС у женщин в перименопаузе и может быть рекомендован для профилактики метаболических нарушений при эстроген-дефицитных состояниях. И.Г. Шестакова Научный центр акушерства, гинекологии и перинатологии РАМН, Москва Литература 1. Spencer C.P., Godsland I.F., Stevenson C. Is there a menopause metabolic syndrome? Gynecol Endocrinol 1997; 11: 341-355. 2. Despres J.P. Abdominal obesity as an important component of insulin-resistance syndrome. Nutrition 1993; 9: 452-459. 3. Barret-Connor E., Wenger N.K., Grady D., Mosca L., Collins P., Kornitzer M., Cox D.A., Moscarelli E., Anderson P.W. Coronary heart disease in women, randomized clinical trials, HERS and RUTH. Maturitas 1998; 31: 1-7. 4. Samsioe G. Hormone replacement therapy and cardiovascular disease. J Cardiovasc Pharmacol 1996; 28: 51-57. 5. Nasr A., Breckwoldt M. Estrogen replacement therapy and cardioprotection: lipid mechanisms are the tip of an iceberg. Gynecol Endocrinol 1998; 12: 43-59. 6. Ferraro R., Lillioja S., Fontvieille A.-M., Rising R., Bogardus C., Ravussin E. Lower sedentary metabolic rate in women compared with men. Clin Invest 1992; 90: 780. 7. Milewicz A., Bidziсska B., Sidorowicz A. Perimenopausal obesity. Gynecol Endocrinol 1996; 10: 285-291. 8. Bjцrtorp P. Abdominal obesity and the metabolic syndrome. Ann Med 1992; 24: 465-468. 9. Godsland I.F. The influence of female sex steroids on glucose metabolism and insulin action. J Int Med 1996; 240: 1-60. 10. Gambacciani M., Ciaponi M., Cappagli B., Piaggesi L., DeSimone L., Orlandi R., Genazzani A.R. Body weight, body fat distribution, and hormonal replacement therapy in early postmenopausal women. J Clin Endocrinol Metab 1997; 82: 414-417. 11. Haarbo J., Marskew U., Gottfredsen A., Christiansen C. Postmenopausal hormone replacement therapy prevents central distribution of body fat after menopause. Metab Clin Exp 1991; 40: 323-326. |