Гормональная контрацепция и тромбофилические состояния.
|
В последние годы в связи с открытием ряда ранее неизвестных генетически обусловленных дефектов гемостаза, предрасполагающих к тромбозу (мутация фактора V Leiden, мутация протромбина и пр.), стало возможным объяснение ранее необъяснимых случаев тромботических осложнений при приеме оральных контрацептивов (ОК). Это, несомненно, должно способствовать правильному отбору пациенток для гормональной контрацепции. Учитывая дороговизну генетических исследований в качестве скрининга перед назначением гормональной контрацепции, следует внимательно изучать семейный и личный тромботический анамнез, наличие дополнительных факторов риска (курение, ожирение и пр.). Однако хотя таким образом можно снизить риск тромботических осложнений, избежать их полностью не удается. К сожалению, тот или иной генетический дефект, предрасполагающий к тромбозу, чаще всего диагностируется уже после эпизода тромбоза [6-8, 11].
Целью исследования явилось изучение роли генетических форм тромбофилии в структуре тромботических осложнений при приеме ОК второго и третьего поколений. Материал и методы Для генетических исследований отобраны 39 женщин в возрасте 18-32 лет из 474 получавших комбинированные ОК второго и третьего поколений (мерсилон, силест, три-регол) в течение 3-18 мес. Показанием для проведения исследований служили клинические проявления в виде тяжелой мигрени (у 10 женщин), болей в икроножных мышцах (у 18), ухудшения зрения (у 1), тромбоза глубоких вен голени (у 2) и илеофеморального тромбоза (у 1), а также лабораторные признаки тромбофилии (высокий уровень комплексов тромбин-антитромбин (ТАТ) F1+2 протромбина и D-Dimer). Вышеописанная клиническая симптоматика и появление маркеров тромбофилии отмечены в первые 3 мес приема контрацептивов. Гинекологический анамнез: нарушение менструальной функции у 8 женщин (у 3 - олигоменорея, у 5 - альгоменорея). Изучение инфекционного профиля показало довольно высокий процент бактерио- и вирусоносительства: у 10 (25,6%) женщин был выявлен хламидиоз, у 7 (18%) - уреаплазмоз, у 4 (10,3%) - генитальный герпес, у 1 (2,6%) - цитомегаловирусная инфекция, у 2 (5,1%) - хронический эндометрит, у 6 (15,4%) - неспецифический кольпит, у 1 (2,6%) - эндометриоз, у 11 (28,2%) - хронический сальпингоофорит, у 5 (12,3%) - гарднерелез. Искусственные аборты ранее были у 19 (49%) женщин, из них 10 (26%) - нерожавших. Из 39 женщин нерожавших было 20 (51,3%), рожавших 1 раз - 12 (30,8%) и 2 раза - 3 (7,7%). Исходы предыдущих беременностей: всего беременностей - 58 (100%), родов - 18 (31%), преждевременных родов- 6 (10,3%), искусственных абортов - 25 (43%), самопроизвольных абортов - 22 (38%), неразвивающихся беременностей - 8 (13,4%), внематочная беременность - 1 (1,7%). Ранее другими методами предохранялись от беременности 19 (49%) женщин, не предохранялись - 20 (51%). С целью дифференциальной диагностики тромбофилических состояний всем больным проведены исследования для выявления генеза тромбофилии. Исследования включали определение мутации фактора V Leiden, мутации протромбина, метилентетрагидрофолатредуктазы (MTHFR) С677T методом ПЦР, определение антитромбина III (АТ-III), протеина С, S с использованием хромогенных субстратов (STAGO, Франция), а также определение антифосфолипидных антител (АФА): волчаночного антикоагулянта (ВА) - с использованием скринирующих и подтверждающих проб, антикардиолипиновых антител, анти-b-GPI, антипротромбиновых антител иммуноферментным методом (STAGO, Франция). Результаты исследования В результате исследований из 39 женщин у 17 (3,5% от общего числа обследованных) выявлены генетические формы тромбофилии: у 5 — мутация фактора V Leiden (y 1 — гомозиготная, у 4 — гетерозиготная форма), у 1 — гетерозиготная мутация протромбина G20210A, у 8 - мутация MTHFR С677Т (у 2 - гомозиготная), у 1 - синдром липких тромбоцитов, у 1 - дефицит протеина С (табл. 1, 2). Сочетание двух генетических дефектов обнаружено у 2 женщин: у 1 - гетерозиготная мутация протромбина и гетерозиготная мутация MTHFR С677Т и у 1 - гетерозиготная мутация фактора V Leiden и гетерозиготная мутация MTHFR С677Т. Таблица 1. Наследственные тромбофилические состояния у 39 обследованных пациенток
Таблица 2. Результаты специальных генетических исследований скрытой тромбофилии у пациенток с клиническими (15) и лабораторными (24) проявлениями тромбофилии (39)
Примечание. +/- гетерозиготная форма; +/+ гомозиготная форма. Таблица 3. Прямые методы диагностики тромбофилии у 39 женщин с клиническими и/или лабораторными признаками тромбофилии на фоне приема ОК второго и третьего поколений
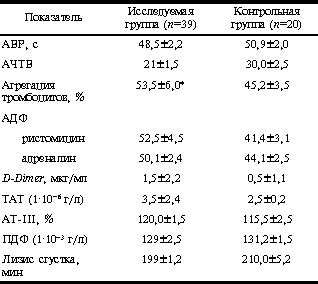
У 15 женщин впервые была выявлена циркуляция АФА. При этом у 3 женщин имело место сочетание гипергомоцистеинемии (у 2 - гетерозиготная мутация MTHFR С677Т и у 1 - гомозиготная) с циркуляцией АФА. Важно отметить, что в анамнезе у этих женщин не было клинических проявлений, свойственных антифосфолипидному синдрому. У 9 пациенток причина появления маркеров тромбофилии на фоне приема КОК осталась невыясненной. При исследовании маркеров тромбофилии их уровень был повышен у всех женщин (табл. 3). Анализ агрегации тромбоцитов позволил выявить повышение активности тромбоцитов у 20 женщин. Отмечалось преобладание "высоких" агрегационных кривых, с отсутствием второй волны. При этом стимуляция слабыми агонистами (АДФ 1·10, АДФ 1·10) не сопровождалось характерной дезагрегацией. У 1 женщины отмечалось изолированное повышение агрегации тромбоцитов при стимуляции исключительно АДФ и адреналином в концентрации 1·10, 1·10; 1·10 и 1·10 соответственно. Остальные индукторы агрегации (ристомицин, коллаген, арахидоновая кислота) не вызывали повышенной агрегации тромбоцитов. Учитывая вышесказанное, а также клинические проявления в форме тяжелой мигрени, нами были обследованы мать, отец и брат пациентки. Только у матери были обнаружены подобные изменения агрегационной активности тромбоцитов. При более детальном сборе анамнеза выяснилось, что у матери пациентки во время последней беременности были эпизоды транзиторных ишемических атак. На основе данных агрегационной активности тромбоцитов, клинических проявлений и анамнестических данных нами был поставлен диагноз синдрома липких тромбоцитов. Рутинные методы исследования гемостаза (АЧТВ, АВР и пр.) не обнаружили каких-либо изменений, что подтверждает нецелесообразность применения этих методов в качестве скринирующих методов для выявления тромбофилии. В табл. 4 представлены параметры гемостаза у обследованных женщин. Возвращаясь к клиническим проявлениям тромбофилии у обследованных нами пациенток, следует отметить, что тромботические проявления у 3 женщин с генетически обусловленной тромбофилией манифестировали уже в первые месяцы приема комбинированных ОК: у 2 женщин на 2-3-м месяце и у 1 - уже в первом цикле приема ОК. Ниже приводится описание двух клинических случаев тромбоза. 1. Пациентка Л., 18 лет, на 2-м месяце приема ОК третьего поколения развился илеофеморальный тромбоз. Половая жизнь с 17 лет, беременностей в анамнезе не было. До назначения ОК пациентке были проведены скринирующие исследования на предмет тромбофилии (ТАТ, D-Dimer). Функции тромбоцитов в пределах нормальных величин. Проба на ВА отрицательная в трех скринирующих исследованиях. Семейный анамнез не отягощен, у пациентки также не было тромбозов в анамнезе. Поэтому тромботическое проявление на фоне приема ОК было неожиданным и послужило причиной для более подробного анализа семейного анамнеза и проведения исследований, направленных на выявление генетической формы тромбофилии. Таблица 4. Параметры системы гемостаза на фоне приема ОК второго и третьего поколений
Примечание. ПДФ - продукты деградации фибриногена. p вычисляли в сравнении ... - p < 0,05, во всех остальных случаях различия недостоверны (p>0,05). Уровень АТ-III и протеина С был в пределах нормы. Однако при проведении ДНК-диагностики выявлено наличие гетерозиготной мутации гена MTHFR С677Т и гетерозиготной мутации гена фактора V Leiden. Таким образом, имел место мультифакториальный генез тромбофилии. Уровень маркеров тромбофилии был значительно повышен: комплексы ТАТ 5,5·10г/л, D-Dimer > 3 мкг/мл. При более тщательном анализе семейного анамнеза выяснилось, что у матери пациентки был отягощенный акушерский анамнез (привычное невынашивание, преждевременная отслойка нормально расположенной плаценты). У деда по отцовской линии — рак толстой кишки. Родителям пациентки также был проведен ДНК-анализ. При этом у матери была выявлена гетерозиготная мутация фактора V Leiden, у отца — гомозиготная мутация MTHFR С677Т. Пациентка переведена на антикоагулянтную терапию. Рекомендованы альтернативные методы контрацепции. Анализируя приведенный клинический случай, следует отметить, что молодой возраст пациентки, когда тромботического анамнеза может еще нет (беременности, оперативных вмешательств и пр.), должен особо настораживать при назначении комбинированных ОК. В таких случаях необходимо выяснять не только тромботический семейный анамнез, но и акушерский и общесоматический анамнез родителей, учитывая роль генетических дефектов гемостаза, предрасполагающих к тромбозу, в патогенезе акушерских осложнений, онкологических и других заболеваний. Идеально при назначении комбинированных ОК юным пациенткам проводить генетические исследования на предмет генетических дефектов гемостаза, предрасполагающих к тромбозу, хотя следует признать, что эти исследования не всегда и не везде возможно осуществить не только из-за их дороговизны, но и, в первую очередь, из-за отсутствия возможности диагностики в широкой практике [10, 11, 15]. 2. Пациентка К., 30 лет. В анамнезе 1 искусствен ный аборт на ранних сроках беременности без осложнений. Соматический анамнез не отягощен. Ранее от беременности предохранялась барьерными методами. После искусственного аборта стала предохраняться от беременности КОК третьего поколения три-реголом. На 3-м месяце приема комбинированного ОК стала отмечать боли в икроножных мышцах, мигрень. При первичном скрининге у пациентки маркеры тромбофилии (TAT, D-Dimer) в пределах верхней границы нормы (2,5·10г/л, 0,5 мкг/мл соответственно), проба на ВА отрицательная, функция тромбоцитов также в пределах верхней границы нормы (Т = 48±2,5 с различными агонистами). Проведенные вторично скринирующие исследования на 3-м месяце приема ОК обнаружили тромбофилию: уровень ТАТ повышен до 4,5·10г/л, D-Dimer - до 3 мкг/мл. Функция тромбоцитов также была повышена: Т составила 69, 80 и 75% для АДФ 1·10 м, ристомицина и адреналина соответственно. Проба на ВА оказалась положительной (в скринирующем тесте dRVVT и подтверждающем использованием фосфолипидов тромбоцитарного происхождения (метод тромбоцитов)). Учитывая выраженные лабораторные признаки тромбофилии и клинические проявления, с целью исключения генетически обусловленной причины тромбофилии проведен ДНК-анализ на мутации генов фактора V Leiden, протромбина G20210A и MTHFR С677Т. С помощью хромогенных субстратов определялась концентрация естественных антикоагулянтов АТ-III и протеина С. В результате проведенных исследований выявлена гомозиготная мутация MTHFR С677Т. При допплерометрии обнаружен тромбоз глубоких вен левой голени. Пациентке начата терапия антикоагулянтами, фолиевой кислотой и витаминами группы В. Рекомендованы альтернативные методы контрацепции. Характерно, что в семейном анамнезе у пациентки не было тромбофилических осложнений. Хотя у отца в возрасте 50 лет отмечались приступы стенокардии. При генетическом анализе у отца пациентки выявлена гомозиготная мутация MTHFR С677Т, у матери - гетерозиготная форма той же мутации. Таким образом, гипергомоцистеинемия и АФА (ВА) были причиной мультифакториальной тромбофилии, которая на фоне гормональной контрацепции дополнительного тригера реализовалась в форме тромбоза глубоких вен голени. Здесь же следует отметить, что наличие приступов стенокардии у отца в довольно молодом возрасте должно было насторожить врача в отношении гипергомоцистеинемии, которая, как известно, является причиной ранней заболеваемости коронаров и тромбозов. Обсуждение и выводы Подводя итог, следует еще раз отметить, что современная гормональная контрацепция является значительным достижением клинической медицины, поскольку способствует утверждению современной концепции планирования семьи, повышению качества жизни женщины. Гормональная контрацепция существенно снижает число нежелательных беременностей, играет доминирующую роль в профилактике абортов и послеабортных осложнений, угрожающих жизни женщины, и является одним из интегральных факторов, снижающих материнскую смертность [3, 5, 6, 8]. Тем не менее, несмотря на значительное улучшение качества ОК за последние 10-15 лет, полностью избежать ятрогенных тромбофилических осложнений не удалось. Во многом пониманию этих явлений способствовало открытие за последние 7 лет ряда ранее неизвестных скрытых генетически обусловленных дефектов гемостаза, предрасполагающих к тромбозу (мутация фактора V Leiden, мутация протромбина G20210А, синдром липких тромбоцитов, дефект Wein—Penzing, гипергомоцистеинемия и пр.). Другим важнейшим фактором, объясняющим возникновение сосудистых и внутрисосудистых расстройств при применении современных контрацептивов, явилось установление роли циркуляции АФА и антифосфолипидного синдрома при ряде состояний организма, среди которых важнейшее значение для обсуждаемой проблемы имеет бактерио- и вирусоносительство, наличие стертых форм системных заболеваний, прием ряда лекарственных препаратов [5, 12, 14, 15]. Сочетание скрытых форм генетической и приобретенной тромбофилии является крайне неблагоприятным фоном для применения даже современных низкодозированных комбинированных ОК. Проблема осложняется еще и тем, что наиболее часто современные контрацептивы используют молодые женщины, еще не имеющие тромботического анамнеза, что не исключает наличие у них генетической предрасположенности к тромбозам [4, 13]. В связи с этим мы считаем оправданной при рекомендации гормональной контрацепции оценку семейного тромботического анамнеза. При этом следует обратить внимание на наличие не только тромбозов и тромбоэмболий у отца, матери, братьев, сестер, но и инфарктов, привычного невынашивания, тяжелых гестозов, преждевременной отслойки нормально расположенной плаценты и пр. При подозрительном анамнезе крайне желательно проведение скринирующих и специальных исследований системы гемостаза [9]. Важно отметить, что наиболее ценными скринирующими методами исследования гемостаза в подобных случаях являются определение маркеров тромбофилии - мономеров фибрина, комплексов TAT, D-Dimer, а также агрегации тромбоцитов, определение АФА. Использование в качестве скрининга таких методов, как определение уровня фибриногена, АЧТВ, АВР, ПИ, не оправдано в связи с их неинформативностью [11-14]. Диагностически важным критерием является уровень гомоцистеина в крови, высокие концентрации которого диктуют необходимость выявления генетического дефекта и/или соответственно приобретенных факторов гипергомоцистеинемии [15]. К сожалению, весьма часто диагностика генетической формы тромбофилии осуществляется уже после тромботического эпизода. Возможно, в будущем генетические исследования тромбофилии будут и в нашей стране общедоступны, что позволит при необходимости резко повысить уровень скрининга. Следует также отметить, что в свете полученных за последние годы данных о роли генетических форм тромбофилии в патогенезе осложненного течения беременности своевременное их выявление приобретает огромное прогностическое значение. А.Д. Макацария, М.А. Джангидзе, В.О. Бицадзе, А.Л. Мищенко, Н. Шахаратова, Н.В. Сусарева Кафедра акушерства и гинекологии медико-профилактического факультета Московской медицинской академии им. И.М. Сеченова Литература 1. Савельева И.С. Молочные железы и гормональная контрацепция. Гинекология 1999; 1: 1: 2, 3. 2. Габуния М.С., Лобова Т.А., Чепелевская Э.Н. Состояние молочных желез при гормональной контрацепции. Акуш и гин 1999; 6: 26-30. 3. Нерсесян Р.А. Современные тенденции в развитии методов контрацепции. Пробл репрод 1998; 5: 5-11. 4. Прилепская В.Н., Тагиева А.В. Гормональная внутриматочная рилизинг-система "Мирена". Контрацепция и здоровье женщины 2000; 1 (5): 11-19. 5. Серов В.Н., Прилепская В.Н., Кожин А.А. Гормональная контрацепция. Контрацепция и здоровье женщины 2000; 1 (5): 36-45. 6. Саидова Р.А. Современные контрацептивы. Рус мед журн 2000; 8: 11: 453-460. 7. Саидова Р.А., Макацария А.Д. Климактерический период: возможности заместительной гормональной терапии. Рус мед журн 1999; 7: 18: 870-874. 8. Саидова Р.А., Макацария А.Д., Джангидзе М.А. Гормональные контрацептивы оптимальный выбор. Рус мед журн 1999; 7: 18: 878-882. 9. Lane D.A., Mannucci P.M., Bauer K.A. et al. Interited thrombophilia: part 2. Thromb Haemost 1996; 76: 824. 10. Bertina R.M. Molecular risk factors for thrombosis. Thromb Haemost 1999; 82: 601. 11. Van Boven H.H., Reistma P.H., Rosendaal F.R. et al. Factor V Leiden (FVR 506Q) in families with inherited antithrombin deficiency. Thromb Haemost 1996; 75: 417. 12. Quenherberger P., Loner U., Kapiotis S. et al. Increased levels of anticulating trombomodulin during use of oral contraceptives. Thromb Haemost 1996; 76: 729. 13. Corand J., Hovellou M.H., Van Dreden P., Lecompte Т., Samama M. Thrombosis and pregnancy in congenital deficiencies in antithrombin III, protein С or protein S: study of 78 women. Thromb Haemost 1990; 63: 319. 14. Ginsberg J.S., Kearon C., Douketis K. et al. D-dimer and impedance plethysmography in patients with suspected deep vein thrombosis: results of a management trial. Arch Int Med 1997; 157: 1077. 15. Hemostasis and Thrombosis: Basis Principles and Clinical Practice. Ed. Robert W. Colman et al. Fourth Edition, 2001. Врач: - Сколько Вам лет, мадам Мулен? - Я недавно подошла к 30-ти…. - И что же вас так задержало в пути?
|