Анализ результативности программ TESE и MESA в зависимости от типа азооспермии.
|
Методики TESE (testicular sperm extraction) и MESA (microsurgical sperm aspiration) получили широкое распространение с момента появления метода микроинъекции сперматозоида в яйцеклетку (ICSI) в начале 90-х годов прошлого столетия. Указанные методики применяются при азооспермии (АЗС) - отсутствии сперматозоидов в эякуляте, либо при так называемой криптозооспермии - отсутствие сперматозоидов в эякуляте при прямой микроскопии и обнаружение 1-5 сперматозоидов в поле зрения после центрифугирования эякулята.
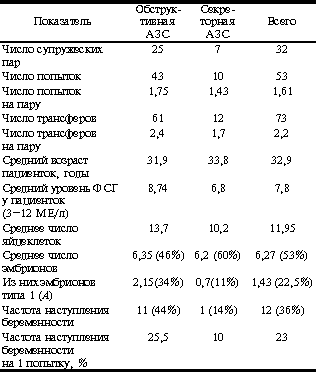
Выделяют обструктивную, или экскреторную АЗС и секреторную АЗС. В случае обструктивной АЗС имеет место механическое препятствие на пути следования сперматозоидов. Секреторная форма АЗС возникает при нарушении сперматогенеза. В некоторых случаях возможно существование смешанных форм (сочетание нарушений секреции с обструкцией выводящих путей). Целью настоящей работы являлся анализ результативности программ TESE- и MESA-ICSI в зависимости от типа и этиологии АЗС у мужчин, а также от состояния репродуктивной функции их жен. Работа выполнена совместно с отделением репродуктивной медицины, госпиталь "Эдуар Эрио", Лион, Франция. Методы исследования Для определения типа и этиологии АЗС изучали уровень ФСГ, ингибина В и a-глюкозидазы. Определяли также объем эякулята и его рН. Принимали во внимание клинические (средний объем testis, наличие варикоцеле) и анамнестические данные (инфекции, передаваемые половым путем, крипторхизм и т.п.) Кроме того, для снижения генетического риска для потомства проводили кариотипирование супругов, а также выявление микроделеций Y-хромосомы и скрининг 5 наиболее распространенных мутаций гена СFTR у мужа и жены. В табл. 1 представлен использованный нами алгоритм дифференциальной диагностики различных типов АЗС. Кроме того, изучали следующие параметры: средний возраст пациентов, длительность бесплодия, данные анамнеза, число яйцеклеток, полученных при ультразвуковой пункции фолликулов (после стимуляции суперовуляции), число и процентное соотношение эмбрионов (из них эмбрионов 1-го типа), число перенесенных эмбрионов, частоту наступления беременности. Результаты Проанализировано 60 случаев АЗС. В 40 (67%) из них определяющим патогенетическим компонентом АЗС являлась обструкция, в 14 (23%) - нарушение секреции, в 18,5% имело место сочетание обструкции с нарушением продукции сперматозоидов. Кроме того, в 3 случаях наблюдался асперматизм - отсутствие эякулята. Еще в 3 (5%) случаях не удалось определить тип АЗС. Данные литературы совпадают с нашими наблюдениями: I. De Croo и соавт. [1] находили обструктивную АЗС в 72% случаев и секреторную в 28% случаев. Проанализированы результаты программы TESE, MESA у 37 супружеских пар. Применялась длинная схема стимуляции (агонисты ГнРГ с 20-го дня менструального цикла). Эмбриотрансфер производили через 72 ч после пункции. Переносили не более 3 эмбрионов. В 25 случаях отмечалась обструктивная АЗС, в 7 - секреторная, в 3 - смешанная. Еще у одного пациента отмечался асперматизм и у одного тип АЗС установить не удалось. Анализ полученных данных проводили в группах обструктивной и секреторной АЗС. Пациенты со смешанным типом, с асперматизмом и АЗС неясной этиологии были исключены из анализа. Полученные данные представлены в табл. 2. Таблица 1. Дифференциальная диагностика различных типов АЗС
Таблица 2. Результаты обследования и частота беременности при разных формах АЗС
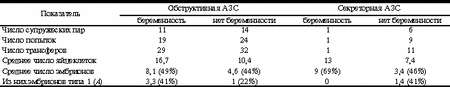
В обеих группах не наблюдалось статистически достоверной разницы в среднем возрасте пациенток, в среднем числе яйцеклеток и в уровне ФСГ. В 12 случаях лечебные программы завершились беременностью. Из них при обструктивной АЗС частота наступления беременности на попытку составила около 26% (р > 0,05), частота наступления беременности на пациентку - 42% (р > 0,05). При секреторной АЗС частота наступления беременности на попытку составила 10% (р < 0,05), частота наступления беременности на пациентку - около 14% (р<0,05). Полученные результаты согласуются с данными литературы [2-4].Обращает на себя внимание достоверно более высокий процент эмбрионов типа 1 (А), а также процент наступления беременности в группе пациенток, мужья которых имели обструктивную АЗС (табл. 3). Обсуждение Анализируя приведенные данные, можно отметить значительно более низкий процент беременностей в группе пациенток, у мужей которых имела место секреторная АЗС. В какой-то мере это может объясняться несколько бульшим средним возрастом и меньшим средним количеством яйцеклеток в вышеописанной группе. Однако среднее число эмбрионов практически одинаково в обеих группах. То же можно сказать и об уровне ФСГ в обеих группах. Обращает на себя внимание разница в числе, а также в процентном соотношении эмбрионов типа 1: их достоверно больше в группе пациенток, мужья которых имели обструктивную АЗС. Это может объясняться большим числом хромосомных аномалий у пациентов с секреторной формой АЗС и соответственно большим количеством нежизнеспособных эмбрионов [5, 6]. Тот же феномен можно наблюдать и при сравнении показателей в группах с наступлением беременности и при ее отсутствии: процентное соотношение эмбрионов типа 1 (А) достоверно выше в той группе, где наступила беременность. Многочисленные публикации свидетельствуют о том, что именно эмбрионы типа 1 (А) обладают наибольшим потенциалом к дальнейшему развитию [7-9]. Выводы 1. Вероятность наступления беременности достоверно выше в группе пациенток, мужья которых имели обструктивную АЗС. 2. Выявление большого числа хромосомных и генетических аномалий у пациентов с АЗС диктует необходимость обязательного генетического мониторинга перед программами TESE и MESA. 3. Большую долю эмбрионов типа 1 можно считать хорошим прогностическим критерием в программах TESE и MESA. 4. Сочетание секреторной формы АЗС с пониженным овариальным резервом у жены может значительно снизить вероятность наступления беременности в программах TESE и MESA. Таблица 3. Сравнительный анализ клинических и эмбриологических показателей в группах с наступлением беременности и при ее отсутствии
Г. Стрелко, проф. Б. Саль Институт репродуктивной медицины, Киев Литература 1. De Croo I., Van der Elst J., Everaert K., De Sutter P., Dhont M. Fertilization, pregnancy and embryo implantation rates after ICSI. In cases of obstructive and non-obstructive azoospermia. Hum Reprod 2000; 15:6: 1383-1388. 2. Madgar I., Hourvitz A., Levron J., Seidman D.S. et al. Outcome of in vitro fertilization and intracytoplasmic injection of epididimal and testicular sperm extracted from patients with obstructive and non-obstructive azoospermia. Fertil Steril 1998; 69:6: 1080-1084. 3. Ghazzawi I.M., Sarraf M.G., Taher M.R., Khalifa F.A. Comparison of the fertilizing capability of spermatozoa from ejaculates, epididimal aspirates and testicular biopsies using intracytoplasmic sperm injection. Hum Reprod 1998; 13:2: 348-352. 4. Lens J.W. The embryo-practice. Laboratory aspects of in-vitro fertilization. N.V. Organon 1996; 180-181. 5. Ворсанова C.Г., Шаронин В.О., Курило Л.Ф. Аномалии половых хромосом при нарушении репродуктивной функции у мужчин. Пробл репрод 1998; 2: 12-21. 6. Хилькевич Л.В., Здановский В.М., Тагобецкий А.С., Гоголевский П.А. Вспомогательные репродуктивные технологии (TESА и PESА) при лечении бесплодия, обусловленного мужским фактором. Пробл репрод 1998; 2: 29-33. 7. Balaban B., Urman B., Sertac A., Alatas C., Aksoy S., Mercan R. Blastocyst quality affects the success of blastocyst-stage embryo transfer. Fertil Steril 2000; 74:2: 282-287. 8. Vilska S., Tiitinen A., Hyden-Granskog C., Hovatta O. Elective transfer of one embryo results in an acceptable pregnancy rate and eliminates the risk of multiple birth. Hum Reprod 2000; 15:8: 1662. 9. Bar-Hava I., Ashkenazi J., Shelef M., Schwartz A., Brengauz M., Feldberg D., Orvieto R., Ben-Rafael Z. Morphology and clinical outcomes of embryos after in vitro fertilization are superior to those after intracytoplasmic sperm injection. Fertil Steril 1997; 68:4: 653-657. |