Место внутриматочной искусственной инсеминации в преодолении бесплодия.
|
Искусственная инсеминация (ИИ) как метод преодоления бесплодия у человека существует в медицинской практике многие годы. Более 200 лет назад Джон Хантер (John Hunter) впервые с помощью шприца ввел сперму мужчины, страдавшего гипоспадией, во влагалище его жене, и эта процедура закончилась наступлением нормальной беременности [5].
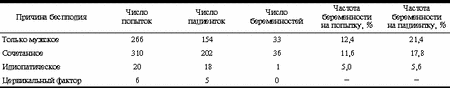
В настоящее время ИИ может быть проведена с применением спермы мужа или донора различными способами: путем введения спермы во влагалище, в цервикальный канал, в брюшную полость, в полость матки, в маточные трубы. Два последних способа вошли в клиническую практику около 40 лет назад. При их применении сперму подвергают предварительной подготовке, аналогичной той, которая используется в ЭКО. При анализе данных литературы обращает на себя внимание большой разброс в оценке эффективности внутриматочной ИИ. По разным источникам, частота наступления беременности при проведении ИИ варьирует от 3 до 40% [1-19]. Результаты проспективных рандомизированных исследований или работ, основанных на большом числе наблюдений, показывают, что эффективность внутриматочной инсеминации составляет 12-17% [20, 21]. Ряд публикаций посвящен изучению зависимости результата лечения от возраста женщины, качества и количества вводимой спермы [6, 16, 14], причин бесплодия [7-9, 13], схемы стимуляции яичников [3, 18, 19]. Из приводимых в этих статьях данных можно сделать вывод, что наилучшие результаты получены у женщин моложе 30 лет, при наличии одной причины бесплодия, на фоне контролируемой индукции суперовуляции, при использовании донорской спермы. Показания к ИИ достаточно четко определены отечественными авторами [22]. ИИ спермой мужа показана при гипоспадии уретры, импотенции, отсутствии эякуляции, олигозооспермии при сохраненной нормальной подвижности сперматозоидов и отсутствии их морфологических изменений. У женщин показанием к ИИ спермой мужа являются вагинизм, анатомо-функциональные, иммунологические и воспалительные изменения шейки матки, при которых возникает так называемый цервикальный антагонизм. ИИ спермой донора осуществляется при наличии у мужа азооспермии, олигозооспермии и олигоастенозооспермии с морфологическими изменениями сперматозоидов, не поддающихся лечению; при несовместимости супругов по резус-фактору; наследственных заболеваниях у мужа. К социальным показаниям относится отсутствие полового партнера. Вместе с тем, по данным зарубежной литературы, показанием к ИИ с использованием спермы мужа могут быть женское бесплодие, обусловленное различными нарушениями овуляции, эндометриозом легкой и средней степени, шеечным и иммунологическим фактором, мужское секреторное бесплодие, а также идиопатическое бесплодие [2, 5, 15]. Условием проведения процедуры ИИ является сохраненная проходимость маточных труб; по некоторым источникам, достаточным считается наличие одной проходимой маточной трубы [5]. С появлением и активным использованием новых методов вспомогательной репродукции (экстракорпоральное оплодотворение - ЭКО, интрацитоплазматическая инъекция сперматозоида в яйцеклетку - ИКСИ) и преимплантационной диагностики открылись новые возможности для преодоления бесплодия и наследственной патологии. Врач, обсуждая с пациентами план лечения, среди многих вопросов должен ответить и на следующие два: «Какой из методов вспомогательной репродукции показан?», «Какой из методов является экономически более выгодным для достижения желаемого результата?». В ряде работ последних лет авторы делают вывод, что проведение 3-4 неэффективных циклов ИИ равно по экономическим затратам стоимости проведения цикла ЭКО [1, 2, 4, 8], а дальнейшее лечение с помощью ИИ в такой ситуации является бесперспективным [1, 4, 5]. В то же время к нам обращались больные, которым безуспешно было проведено 17 и даже 30 циклов ИИ. Существующая неопределенность в отношении места ИИ среди других методов вспомогательных репродуктивных технологий (ВРТ), неоднозначность в оценке эффективности этой процедуры послужили основанием для анализа собственного опыта. Материал и методы Нами проведен ретроспективный анализ 602 циклов внутриматочной ИИ спермой мужа/донора у 379 женщин, проходивших лечение бесплодия в период с 1994 по 2000 г. Анализ данных показал, что среди причин бесплодия доминировал мужской фактор, доля которого составила 41%, сочетанное бесплодие имело место в 53% случаев, цервикальный фактор диагностирован в 1% случаев и в 4% случаев причину бесплодия выявить не удалось и они были отнесены к категории «идиопатическое бесплодие». Первичное бесплодие зарегистрировано в 62% случаев, вторичное - в 38%. Наличие спаечного процесса в малом тазу разной степени выраженности, по данным гистеросальпингографии или лапароскопии, при проходимых маточных трубах, отмечено у 10% больных. В анамнезе перенесенные и леченые инфекции органов малого таза имели 7% пациенток. Продолжительность бесплодия колебалась от 1 года до 22 лет и в среднем составила 7±3,4 года. Возраст больных варьировал от 20 до 45 лет и в среднем составил 31±5 лет. Процедура ИИ выполнялась только после получения письменного информированного согласия пациентов. Всем пациентам предоставлялась полная информация, в том числе и об альтернативных методах (ЭКО, ИКСИ, преимплантационная диагностика), заключение врача всегда носило рекомендательный характер. Таким образом, обеспечивалась свобода пациентов в принятии решения. Некоторые пациенты склонялись к ИИ, исходя из своего материального положения в данный момент, желая использовать имеющийся шанс. Обязательным условием для предложения пациентам ИИ являлось наличие хотя бы одной проходимой маточной трубы. Обследование мужчины перед проведением процедуры включало оценку спермограммы, морфологическое и бактериологическое исследование спермы. Нормальными показателями спермограммы считались объем более 1 мл, концентрация сперматозоидов не менее 20 млн/мл, прогрессивно-подвижных форм не менее 50%, аномальных форм не более 50%, степень подвижности сперматозоидов - 2-3, круглых клеток не более 2 млн/мл, морфологически нормальных форм (строгая морфология по методике Крюгера) - не менее 14%. Обследование женщины включало сбор анамнестических данных; определение уровня фолликулостимулирующего, лютеинизирующего гормонов, эстрадиола в сыворотке крови на 2-4-й день менструального цикла, а также уровня пролактина и прогестерона на 20-23-й день менструального цикла. Для оценки состояния внутренних половых органов использовались данные гистеросальпингографии или гистероскопии и лапароскопии. Индукцию овуляции проводили с использованием кломифена и чМГ (хумегон, пергонал, меногон). Кломифен назначали по 100 мг ежедневно со 2-го по 6-й день менструального цикла. чМГ назначали с 3-4-го дня менструального цикла. Доза препарата определялась индивидуально для каждой больной, исходя из данных ультразвукового мониторинга за ростом фолликулов. Для индукции овуляции вводили ХГ (профази, прегнил) в количестве 10 000 ЕД. Показанием к назначению ХГ считалось достижение лидирующим фолликулом среднего диаметра 19 мм. Ультразвуковой мониторинг за ростом фолликулов проводили на ультразвуковом аппарате фирмы "Bruel & Kjaer" (Дания) с использованием трансвагинального датчика с рабочей частотой 7 МГц. Частота исследований зависела от темпов роста фолликулов и эндометрия. Внутриматочная инсеминация проводилась троекратно в периовуляторный период через 18, 32 и 56 ч после введения ХГ. Для отмывки сперматозоидов от семенной жидкости и выделения фракции прогрессивно-подвижных сперматозоидов применялся метод центрифугирования в градиенте перколла. К полученному осадку, состоящему на 95% из прогрессивно-подвижных сперматозоидов, добавляли 0,2-0,3 мл культуральной среды HTF, и полученную фракцию с помощью катетера вводили внутриматочно. Результаты Среднее количество попыток, при которых после проведения ИИ была получена беременность, составило 1,8 на пациентку. Средняя частота наступления беременности при применении ИИ во всей группе составила 11,6% на попытку. Максимальная частота наступления беременности (14,9%) зарегистрирована после первой попытки ИИ. Частота наступления беременности в последующих попытках ИИ была значительно ниже (p< 0,05); после проведения 2 попыток ИИ - 2,8% и после проведения 3 попыток ИИ - 1,8%. В группе пациенток, у которых были проведены 4 попытки ИИ и более, зарегистрированы 2 беременности, частота наступления беременности в этой группе составила 1,8% (табл. 1). Частота наступления беременности в расчете на попытку в группе "только мужское бесплодие" составила 12,4% (табл. 2) и статистически не отличалась от частоты наступления беременности в группе "сочетанное бесплодие" - 11,6% (p>0,05). В группе "идиопатическое бесплодие" получены достоверно худшие результаты - 5% (p<0,05). В группе пациенток с цервикальным фактором бесплодия беременности не наступило, однако из-за малочисленности этой группы невозможно было провести статистически корректную интерпретацию этих данных. Таблица 1. Эффективность ИИ в группах больных с различным количеством попыток ИИ
Таблица 2. Частота наступления беременности при различных причинах бесплодия
Таблица 3. Частота наступления беременности после применения ИИ в группе пациенток с мужским фактором бесплодия
Таблица 4. Частота наступления беременности после применения ИИ в группе пациентов с "сочетанным" бесплодием
Более детальный анализ внутри исследуемых групп показал, что в группе пациенток, где причиной бесплодия явился мужской фактор, наилучшие результаты получены при применении донорской криоконсервированной спермы, частота наступления беременности в этой группе составила 14,9% на попытку и 21,4%, если было проведено более 1 попытки ИИ. При применении спермы мужа в этой группе пациенток частота наступления беременности была в 2 раза ниже и составляла 6,4 и 9,6% (p<0,05) соответственно (табл. 3). Минимальное значение концентрации сперматозоидов в 1 мл, при котором наступила беременность, составило 2 млн/мл, а минимальное количество активно-подвижных сперматозоидов - 14%. Средние значения этих показателей, при которых наступила беременность, составили 50±37 млн/мл и 46,7±15%. При сочетанном бесплодии, как и в группе только с мужским бесплодием, лучшие (p<0,05) результаты лечения достигнуты при применении криоконсервированной донорской спермы (табл. 4). Проанализировано влияние на результат ИИ таких факторов, как перенесенные инфекции органов малого таза, наличие спаечного процесса различной степени тяжести по результатам гистеросальпингографии или лапароскопии при сохраненной проходимости маточных труб в сочетании с любым из вышеуказанных факторов бесплодия. Кроме того, на практике не исключены случаи, когда пациентка настаивает на проведении той или иной процедуры, а врач (при отсутствии формальных противопоказаний) вынужден, в силу различных причин, соглашаться. В этих группах больных частота наступления беременности не превысила 2% (табл. 5). Часть пациенток (18%), начавших лечение с применением метода ИИ с неудачным исходом, впоследствии продолжили его методом экстракорпорального оплодотворения. Эффективность лечения бесплодия в этой группе больных была значительно выше, чем у пациенток, применявших ИИ, и частота наступления беременности в этой группе составила 31%. Обсуждение В нашем центре используются все методы ВРТ. Начиная с 1993 г. отмечается постоянный рост частоты наступления беременности в программах ЭКО. В 2000 году частота беременности на перенос в ЭКО составила 43,9%, ИКСИ - 45,2%, при внутриматочной ИИ - 11,6%. Таблица 5. Влияние дополнительных факторов на частоту наступления беременности при проведении ИИ
Полученные результаты свидетельствуют о достаточно низкой эффективности применения метода ИИ при лечении бесплодия. Исключение составила лишь группа, где основной причиной бесплодия являлся мужской фактор и применялась криоконсер вированная донорская сперма (14,9% на попытку и 25,7% на пациентку). Наличие перитубарных спаек, инфекций, передаваемых половым путем, в анамнезе, а также проведение процедуры по просьбе пациентки (что, как правило, связано с финансовой стороной лечебной процедуры) значительно снижало эффективность ИИ, а частота наступления беременности не превышала 2% на попытку ИИ. Проведение ИИ после 3 неэффективных циклов не приводит к желаемому результату и, по нашему мнению, является малоперспективным, что не противоречит данным литературы [1, 4, 5]. Таким образом, лечение методом ИИ должно иметь достаточно четкие показания. Финансовый аспект не должен превалировать при определении метода лечения бесплодия, так как в случае неэффективности нескольких попыток ИИ в конечном итоге приходится прибегать к более дорогостоящим методам вспомогательной репродукции (ЭКО, ИКСИ), что не только увеличивает суммарную стоимость лечения, но и увеличивает его сроки. Аналогичные данные приводят и другие авторы [1, 2, 4, 8]. Пациенты должны быть информированы о неэффективности применения того или иного метода лечения при наличии дополнительных негативных факторов (инфекционные заболевания органов малого таза в анамнезе и указания на перитубарные спайки по данным гистеросальпингографии или лапароскопии). Выводы Показания к ИИ: со стороны мужчины: - экскреторное бесплодие - патоспермия (субфертильная сперма), предпочти тельно применение донорской спермы - неблагоприятный медико-генетический прогноз (только донорская сперма) со стороны женщины: - отсутствие полового партнера - цервикальный фактор бесплодия Отсутствие эффекта от процедуры в течение 3 циклов следует рассматривать как показание к отказу от ИИ и применению других методов вспомогательной репродукции (ЭКО, ИКСИ). В.С. Корсак, Б.А. Каменецкий, Э.В. Исакова, А.Г. Маринченко Институт акушерства и гинекологии им. Д.О. Отта РАМН; Международный центр репродуктивной медицины, Санкт-Петербург Литература 1. Aboulgar M.A., Mansour R.T. et al. Controlled ovarian hyperstimulation and intrauterine insemination for treatment of unexplained infertility should be limited to a maximum three trials. The Egyptian IVF-ET center, Cairo 11431, Egypt. Hum Reprod 2000; June 15: 1: abstr. 2. Philips Z., Barraza-Liorens M., Posnett J. Evaluation of the relative cost-effectiveness treatment for infertility in the UK. Hum Reprod 2000; January 15: 1. 3. Matorras R. et al. Recombinant human FSH versus highly purified urinary FSH: a randomized study in intrauterine insemination with husband spermatozoa. Department of Obstetrics and Gynecology, Pais Vasco University, Baracololo Vizcaya, Spain. Hum Reprod 2000; June 15: 6. 4. Gowerde A.M. et al. Assisted reproduction: cost-effectiveness study. Lancet 2000; 355: 13-18. 5. Marcus Samuel F., Brinsten P.R. Interuterine insemination. In the book: R. Edwards. A textbook of In-Vitro Fertilization and Assisted Reproduction. Ed. by Peter R. Brinsden. Second edition 1999; 257-265. 6. Van der Westerlaken L.A., Naaktgeboren N., Helmerhorst F.M. Evaluation of pregnancy rates after intrauterine insemination according to indication, age, and sperm parameters. Department of Reproductive Medicine, University Hospital Leiden, The Netherlands. Ass Reprod Genet 1998; 15: 6: 359-364. 7. Rammer E., Friedrich F. The effectiveness of intrauterine insemination in couples with sterility due to male infertility with and without a woman's hormone factor. Department of Gynecology and Obstetrics, General Public Hospital, Horn, Austria. Fertil Steril 1998; 69:1: 31-36. 8. Zayed F., Lenton E.A., Cooke I.D. Comparison between stimulated in-vitro fertilization and stimulated intrauterine insemination for treatment of unexplained and mild male factor. Hum Reprod 1997; 12: 11: 2408-2413. 9. Ombelet W., Vanderput H. et. al. Treatment of male infertility due to sperm surface antibodies: IUI or IVF. Genk Institute for Fertility Technology, St. Jansziekenhuis, Belgium. Hum Reprod 1997; 12: 6: 1165-1170. 10. Van Voorhis B.J., Sparks A.E. et. al. Cost-effectiveness of infertility treatment: a cohort study. Division of Reproductive Endocrinology, University of Iowa College of Medicine, Iowa City, USA. Fertil Steril 1997; 67: 5: 830-836. 11. Legro R.S., Shacleford D.P. et al. ART in women 40 and over. Is the cost worth it? Department of Obstetrics and Gynecology, M.S. Hershey Medical Center, Hershey, PA 17033, USA. Reprod Med 1997; 42: 2: 76-82. 12. Keck C., Gerber-SchЛafer C., Wilhelm C., Vogelgesang D., Breckwoldt. Intrauterine insemination for treatment of male infertility. M. Department of Obstetrics and Gynecology, University Freiburg, Germany. Int J Androl 1997; 20: Suppl 3 (PLWeb Document): 55-64. 13. Comhaure F., Zalata A. et al. Critical evaluation of the effectiveness of different modes of treatment of male infertility. University Hospital Ghent, Department of Internal Medicine, Belgium. Andrologia 1996; 28: Suppl 1 (PLWeb Document): 31-35. 14. Lindheim S.R., Barad D.H., Zinger M., Witt B., Amin H., Cohen B., Fisch H., Barg P. Abnormal sperm morphology is highly predictive of pregnancy outcome during controlled ovarian hyperstimulation and intrauterine insemination. Department of Obstetrics and Gynecology, Albert Einstein College of Medicine, Fertility Hormone Center of Montefiore Medical Center, Dobbs Ferry, New York 10522, USA. J Ass Reprod Genet 1996; 13: 7: 569-572. 15. Hollanders J.M.G., Carver-Ward J.A. et al. Male Infertility from A to Z. A concise encyclopedia. The Parthenon Publishing Group 1996. 16. Cressman B.E., Pace-Owens S., Pliego J.F., Wincek T.J., Kuehl T.J. Effect of sperm dose on pregnancy rate from intrauterine insemination: a retrospective analysis. Department of Obstetrics & Gynecology, Scott and White Clinic, Texas A & M University Health Science Center College of Medicine, Temple, USA. Tex Med 1996; 92:12: 74-79. 17. Campana A., Sakkas D., Stalberg A., Bianchi P.G., Comte I., Pache T., Walker D. Intrauterine insemination: evaluation of the results according to the woman's age, sperm quality, total sperm count per insemination and life table analysis. Department of Obstetrics and Gynecology, Hospital Cantonal University of Geneva, Switzerland. Hum Reprod 1996; 11: 4: 732-736. 18. Allegra A., Volpes A. et. al. Superovulation with busereline and gonadotropins dramatically improves the success rate of intrauterine insemination with husband's washed sperm. Centro Andros, Medical Center for the Diagnosis and Treatment of Infertility, Palermo. Acta Eur Fertil 1990; 21: 4 : 191-195. 19. Tredway D.R., Chan P., Henig I., Gullett A., Cheatwood M. Effectiveness of stimulated menstrual cycles and Percoll sperm preparation in intrauterine insemination. Hillcrest Fertility Center, Tulsa, Oklahoma. J Reprod Med 1990; 35: 2: 103-108. 20. Zorn J.R., Savale M., Gulbert J. et al. Reducing the risk of multiple pregnancies after intra-uterine insemination: a concsecutive series of 2578 IUI with minimal ovarian stimulation. Abstracts of the 16 Annual Meeting of the EHHRE. Bologna, Italy 2000; 118. 21. Ombelet W., Cox A., Janssen M. et al. Intrauterine insemination following superovulation: pragnancy rates after single versus repeated insemination: A prospective randomized study. Abstracts of the 11 Annual Meeting of the EHHRE. Hamburg 1995; 134. 22. Бодяжина В.И., Сметник В.П., Тумилович Л.Г. Неоператив ная гинекология. Руководство для врачей. М 1995. |