Биохимические маркеры костного ремоделирования у женщин с хирургической менопаузой.
|
Изучению клинической значимости маркеров костного ремоделирования при заболеваниях скелета, носящих метаболический характер, посвящены многочисленные работы, тогда как исследования маркеров при хирургической менопаузе ограничены отдельными наблюдениями.
Важным с теоретической и практической точки зрения является сравнительный анализ основных биохимических закономерностей костного ремоделирования у пациенток с хирургической менопаузой и неоперированных того же возраста на основе определения маркеров резорбции и формирования костной ткани. Среди идентифицированных структурных компонентов коллагена I типа специфичными критериями резорбции костной ткани являются пиридинолин (Пид) и дезоксипиридинолин (Дпид), объединяемые в соответствии с их структурой в единое понятие «пиридиновые связи коллагена». При деструкции костного матрикса Пид и Дпид в свободной или связанной с пептидами формах экскретируются с мочой в составе коллагеновых фрагментов [4, 5, 11]. Биохимическим маркером костеобразования является щелочная фосфатаза (ЩФ) и прежде всего ее костный изофермент [8-10, 13, 14]. Целью настоящего исследования являлось сравнительное изучение биохимических маркеров костной резорбции (Пид, Дпид), экскретирующихся с мочой в составе коллагеновых фрагментов при деструкции костного матрикса, а также критерия костеобразования (щелочной фосфатазы сыворотки крови - ЩФ и ее костного изофермента) у женщин с хирургической менопаузой с учетом срока после операции и объема оперативного вмешательства. Материал и методы Исследование маркеров костного ремоделирования проведено у 113 женщин в возрасте от 23 до 50 лет (средний возраст 43,6±0,6 года) с хирургической менопаузой. Из них у 46 женщин была экстирпация матки с придатками, у 43 - субтотальная гистерэктомия с придатками, у 24 - двусторонняя овариэктомия. Показаниями к оперативному вмешательству служили доброкачественные образования матки, опухоли и опухолевидные образования яичников. Из 113 женщин с хирургической менопаузой у 89 яичники были удалены одномоментно, а у 24 пациенток один яичник был удален во время первого оперативного вмешательства, а второй - при повторном чревосечении. Срок после операции составил от 1 до 236 мес. В зависимости от срока после операции больные с одномоментным удалением яичников были разделены на следующие группы (в скобках указан средний возраст): 36 пациенток со сроком после операции до 1 года (43,0±1,5 года), 17 - со сроком 1-2 года (40,8±2,5 года), 10 - со сроком 2-3 года (42,7±2,7 года), 11 - со сроком 3-5 лет (46,6±1,6 лет) и 15 пациенток со сроком после операции более 5 лет (46,6±2,4 года). Пациентки с поэтапным удалением яичников, ввиду относительно небольшого числа, разделены на группы в соответствии со следующими сроками наблюдения: 10 пациенток с послеоперационным сроком до 1 года (43,5±1,1 года), 6 пациенток со сроком 1-2 года (40,8±2,0 лет), 3 пациентки со сроком 3-5 лет (46,0±5,6 лет) и 5 пациенток со сроком более 5 лет (45,4±3,1 года). Контрольную группу составили 113 сопоставимых по возрасту практически здоровых женщин с регулярным менструальным циклом. Исследование Пид и Дпид мочи выполнялось методом жидкостной хроматографии высокого разрешения и предварительной твердофазной экстракции [1]. Конечные результаты стандартизованы по отношению к креатинину исследуемой порции мочи и выражались в нмоль на 1 ммоль креатинина. Определение общей активности ЩФ выполнялось оптимизированным методом на автоматическом анализаторе "Hitachi 911". Активность костной фракции ЩФ определяли иммуноферментным методом при использовании стандартного набора "Alkphase-B" («Metra Biosystems», США). В соответствии со стандартными требованиями, предъявляемыми к статистическому анализу, были рассчитаны пороговые значения биохимических показателей на основе данных, полученных в контрольной группе, с учетом их средних значений и двух стандартных отклонений (M±2 SD), что соответствует 95% доверительному интервалу. Для Пид и Дпид минимальные и максимальные пороговые значения составили 60,6 и 16,8 нмоль на 1 ммоль креатинина, для ЩФ и ее костного изофермента - 250 и 26 ед/л соответственно. Достоверность различий средних значений оценивали по t-критерию Стьюдента. Различия считали достоверными при p < 0,05. Корреляционный анализ проводили при помощи непараметрического критерия Спирмена (R). Все расчеты выполнены на персональном компьютере с помощью программы Statistica for Windows 5,5. Результаты и обсуждение У пациенток с хирургической менопаузой нами установлено усиление общей экскреции с мочой Пид и Дпид по сравнению с практически здоровыми женщинами (табл. 1). Средние значения Пид и Дпид в группе больных превышали в 1,6 раза соответствующие значения в группе контроля, и эти различия были достоверными (p < 0,05). Данные табл. 1 свидетельствуют о существенной вариабельности показателей у пациенток с хирургической менопаузой. Так, в контрольной группе концентрация Пид (23,8-64,7 нмоль на 1 ммоль креатинина) и Дпид (5,3-16,9 нмоль на 1 ммоль креатинина) варьировала в небольших пределах, тогда как для больных была характерна выраженная вариабельность значений Пид (33,1-174,5 нмоль на 1 ммоль креатинина) и Дпид (4,9-41,2 нмоль на 1 ммоль креатинина). В общей группе степень усиления экскреции колебалась в широких пределах и составляла для Пид 1,3-2,7 раза, для Дпид 1,7-2,4 раза. Следует отметить, что при анализе выявленных изменений в зависимости от характера оперативного вмешательства оказалось, что наиболее выраженное усиление экскреции пиридиновых связей коллагена было характерно для больных с одномоментным удалением яичников, у которых степень повышения концентрации Пид и Дпид соответствовала 2,7 и 2,4 раза. Эти же степени повышения у больных с поэтапным удалением яичников составляли 1,5 и 1,6 раза для Пид и Дпид соответственно. Однако в целом средние значения у больных с одномоментным и поэтапным удалением яичников достоверно не различались (см. табл. 1). Таблица 1. Концентрация маркеров костной резорбции у больных с хирургической менопаузой и практически здоровых женщин
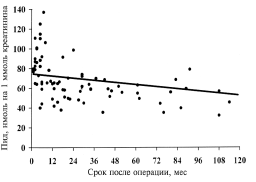
Примечание. Здесь и в табл. 2-4: в скобках - пределы колебаний. * - достоверность различий показателей по отношению к контролю (р < 0,05). При анализе зависимости экскреции пиридиновых связей коллагена от длительности хирургической менопаузы установлено, что при хирургической менопаузе концентрация Пид и Дпид была достоверно (p < 0,05) повышена во все сроки после овариэктомии по отношению к группе практически здоровых женщин. Средние значения концентрации Пид и Дпид у больных при различных сроках после овариэктомии представлены в табл. 2, из которой видно, что максимальная степень их повышения (2,1 раза) по сравнению с контрольной группой наблюдалась у женщин с одномоментным удалением яичников и послеоперационным сроком до 1 года. В более продолжительные сроки степень повышения пиридиновых связей коллагена была ниже (1,3-1,5 раза). При дополнительном анализе концентрации Пид и Дпид в разные сроки после операции установлено, что их наиболее высокие концентрации наблюдались у женщин в первый год после овариэктомии как в общей, так и в группах с поэтапным и одномоментным удалением яичников и достоверно (p < 0,05) превышали концентрации в более поздние сроки (см. табл. 2). Необходимо добавить, что установлена обратная корреляционная зависимость между концентрацией пиридиновых связей и сроком после операции, которая имела достоверный характер. Коэффициент корреляции для Пид составил R=-0,601 (p < 0,001) (рис. 1). При этом максимальные значения концентрации Пид и Дпид наблюдались в более ранние сроки (до 1 года) после овариэктомии. С увеличением срока после операции (от 2 до 5 лет и более) концентрация маркера постепенно снижалась. Для Дпид подобная зависимость была менее выраженной (R=-0,348), однако также носила достоверный характер (p < 0,001). Таблица 2. Концентрация Пид и Дпид у женщин с хирургической менопаузой в зависимости от сроков после овариэктомии
Примечание. ** - достоверность различий показателей по отношению к другим срокам после операции (р < 0,05), остальные обозначения те же, что в табл. 1.
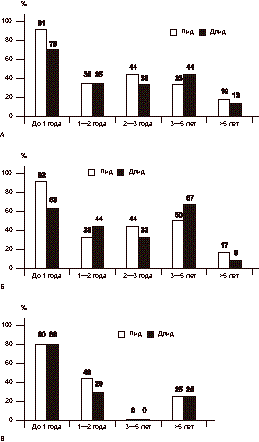
Анализ распределения значений Пид и Дпид в общей группе показал, что у большинства женщин с хирургической менопаузой усилена экскреция обоих аналогов. Увеличение концентрации Пид по отношению к пороговому значению (60,6 нмоль на 1 ммоль креатинина) обнаружено у 55% обследованных пациенток. Уровень Дпид выше установленной в нашем исследовании нормы (16,8 нмоль на 1 ммоль креатинина) был выявлен в 45% случаев. При этом в группах больных с одномоментным и поэтапным удалением яичников частота повышения концентрации Пид и Дпид была приблизительно одинаковой, составив 57 и 50% для Пид и 45 и 46% для Дпид соответственно. При анализе частоты усиления экскреции Пид и Дпид в зависимости от срока после овариэктомии установлено, что у большинства обследованных женщин с хирургической менопаузой повышение концентрации маркеров костной резорбции наблюдалось в более ранние сроки после операции. В первый год после удаления яичников уровень Пид был повышен у 91% обследованных женщин, Дпид - у 70% (рис 2, а). При изучении частоты и степени повышения экскреции Пид и Дпид мочи в более поздние сроки (от 1 года до 5 лет) установлено постепенное снижение показателей с увеличением сроков наблюдения. Усиление экскреции в данные сроки наблюдалось у 33-44% обследованных женщин (см. рис. 2, а). Наименее выраженной была частота повышения уровня маркеров костной резорбции у женщин со сроком более 5 лет после овариэктомии (см. рис. 2, а).
А - общая группа больных; Б - больные с одномоментным удалением яичников; В - больные с поэтапным удалением яичников. При последующем анализе в группах больных с одномоментным и поэтапным удалением яичников установлено, что в обеих группах наибольшее число женщин с повышенными концентрациями Пид и Дпид наблюдалось при сроке до 1 года после операции (рис. 2, б, в). Частота повышения экскреции Пид и Дпид для женщин с одномоментным удалением яичников составила 92 и 63%, при поэтапном удалении яичников оба маркера были повышены в 80% случаев. В сроки от 1 года до 5 лет в обеих группах частота усиления экскреции пиридиновых связей была значительно ниже, чем у женщин в течение первого года после овариэктомии (см. рис. 2, б, в). У женщин в отдаленные (более 5 лет) сроки после оперативного вмешательства частота повышения экскреции Пид и Дпид была еще ниже. Таким образом, хирургическая менопауза сопровождается усилением экскреции Пид и Дпид, наиболее выраженной в первый год после удаления яичников, с последующим уменьшением ее интенсивности в более поздние (2-5 лет) сроки и практической нормализацией через 5 лет после операции за исключением некоторых больных, у которых концентрация маркеров костной резорбции оставалась повышенной и более 5 лет. Установленная закономерность свидетельствует об усилении костной резорбции в ближайший год после овариэктомии с постепенным снижением ее интенсивности к 5 годам. При анализе результатов определения маркеров костеобразования выявлены менее выраженные изменения по сравнению с показателями резорбции (табл. 3). Общая активность ЩФ сыворотки крови у пациенток с хирургической менопаузой в среднем была на 32% повышена (p < 0,05) по отношению к активности ЩФ у практически здоровых женщин. Однако средняя активность ЩФ была ниже порогового уровня, рассчитанного на основании показателей контрольной группы (250 ед/л). При этом гиперферментемия наблюдалась лишь у 14% пациенток, у остальных женщин значения общей активности ЩФ не превышали порогового уровня. В целом изменения общей активности ЩФ, как известно, зависящие от различных факторов, соответствовали физиологической вариабельности. Активность костной фракции ЩФ в среднем была несколько снижена (на 19,7%) по сравнению с показателем контрольной группы и была также ниже рассчитанного порогового значения (26 ед/л). Следует также добавить, что снижение активности костной ЩФ выявлено у 7 (8%) из 87 обследованных женщин, у остальных женщин (у 92%) костная ЩФ находилась в пределах контроля. Анализ зависимости активности ЩФ и ее костного изофермента от сроков после операции показал, что как в общей группе, так и в группах с поэтапным и одномоментным удалением яичников независимо от срока после операции общая активность ЩФ была несколько повышена по отношению к показателю контрольной группы. Однако эти изменения находились в пределах нормативных значений (табл. 4). Активность костного изофермента ЩФ была на 21,2% снижена (p < 0,05) у женщин с послеоперационным сроком до 1 года по сравнению с практически здоровыми женщинами. В последующие сроки (более 1 года) наблюдалась тенденция к увеличению активности костной ЩФ, которая не достигала достоверных различий по отношению к контрольной группе (см. табл. 4). Следует отметить, что хотя выявленные изменения показателей активности ЩФ и ее костного изофермента носили достоверный характер, все они находились в пределах вариабельности контрольной группы. С учетом того, что общая активность ЩФ зависит от ряда факторов, в частности от состояния функции печени, а также слабой выраженности установленных изменений, представляется целесообразным учитывать данные определения костной фракции ЩФ как маркера костеобразования в связи с ее большей специфичностью. Таким образом, полученные данные отражают основные патогенетические механизмы нарушения костного метаболизма у пациенток с хирургической менопаузой. Последняя сопровождается усилением костной резорбции, наиболее выраженной в первый год после удаления яичников (быстрая фаза), с последующим уменьшением ее интенсивности в более поздние сроки (медленная фаза). Резкое усиление процессов костной резорбции при одновременном снижении процессов формирования, возникающее уже в первые месяцы после оперативного вмешательства, является причиной столь быстрой потери костной ткани в первый год после овариэктомии. Изменения в костном гомеостазе после билатеральной овариэктомии являются более драматическими по сравнению с нарушениями, возникающими вследствие постепенного снижения продукции половых стероидов яичниками при естественной менопаузе. Остро возникающий дефицит половых гормонов после овариэктомии вызывает нарушение баланса двух сопряженных процессов костного ремоделирования - образования и резорбции кости, что приводит к быстрой потере костного вещества, достигающей 10-17% уже в течение первого года после оперативного вмешательства [1, 2, 6, 12]. Таким образом, за первые пять лет после овариэктомии женщина может потерять до 20-25% костной массы, что способствует увеличению риска переломов в последующей жизни [1, 6, 7]. Экскреция пиридиновых связей коллагена и активность костного изофермента ЩФ являются объективными биохимическими признаками интенсивности костного ремоделирования у больных с хирургической менопаузой. Показатели костной резорбции (Пид и Дпид) являются более чувствительными маркерами метаболизма костной ткани, что можно объяснить большей быстротой биологического ответа показателей резорбции по сравнению с показателями костеобразования. Таблица 3. Активность ЩФ и ее костного изофермента (в ед/л) у больных с хирургической менопаузой и в контрольной группе
Таблица 4. Концентрация ЩФ и ее костного изофермента (в ед/л) у женщин с хирургической менопаузой в зависимости от сроков после овариэктомии
Таким образом, с целью профилактики остеопороза у женщин с хирургической менопаузой исходную оценку минеральной плотности костной ткани при помощи DEXA представляется целесообразным дополнять определением биохимических маркеров костной резорбции - Пид, Дпид, что является важным неинвазивным тестом, способствующим повышению точности ранней диагностики нарушений костного метаболизма у женщин после овариэктомии, и позволит своевременно назначать антирезорбтивную терапию. С.В. Юренева Научный центр акушерства, гинекологии и перинатологии РАМН, Москва Литература 1. Краснопольский В.И., Рубченко Т.И. Хирургическая менопауза. Пробл репрод 1998; 5: 76-80. 2. Сметник В.П. Постменопаузальный остеопороз: принципы заместительной гормонотерапии. Остеопороз и остеопатии 1998; 2: 21-24. 3. Black D., Duncan A., Robins S.P. Quantitative analysis of the pyridinoline crosslinks of collagen in urine using ion-paired reversed-phase HPLC. Anal Biochem 1988; 169: 197-203. 4. Delmas P.D. Biochemical markers of bone turnover. Acta Orthop Scand 1995; 66: (Suppl 266): 176-182. 5. Eyre D.R., Oguechi H. The pyridinium crosslinks of skeletal collagens: their measurement, properties and a proposed pathway of formation. Biochem Biophys Res Commun 1980; 92: 403-410. 6. Hashimoto K., Nozaki M., Inoue Y. et al. The chronological change of vertebral loss following oophorektomy using dual energy X-ray absorbtiometry: the correlation with specific merkers of bone metabolism. Maturitas 1995; 22: 185-192. 7. Hreshchychyn M., Hopkins A., Zylstra S. et al. Effects of natural menopause, hysterectomy and oophorectomy on lumbar spine and femoral neck bone densities. Obstet Gynecol 1998; 2: 8: 631-638. 8. Kress B.C. Bone alkaline phosphatase in normal and disease processes. In: Schmidt-Gayk H.E., Blind E., Roth H.-J. (eds): Calcium Regulating Hormones and Markers of Bone Metabolism: Measurement and Interpretation. Heidelberg. Clin Lab Publ 1997; 171-181. 9. Price C.P. Multiple forms of human serum alkaline phosphatase: Detection and quantitation. Ann Clin Biochem 1993; 30: 355-372. 10. Price C.P., Thompson P.W. The role of biochemical tests in the screening and monitoring of osteoporosis. Ann Clin Biochem 1995; 32: 244-260. 11. Robins S.P., Black D., Paterson C.R., Reid D.M., Duncan A., Seibel M.J. Evaluation of urinary hydroxypyridinium crosslink measurements as resorption markers in metabolic bone diseases. Eur J Clin Invest 1991; 21: 310-315. 12. Sands R., Studd W.M., Jones J., Alaghband. Comparison of the biochemical effects of testosteron and estrogen on bone markers in surgically menopaused women. Gynecol Endocrinol 2000; 14: 382-387. 13. Van Straalen J.P., Sanders E., Prummel M.F., Sanders G.T.B. Bone-alkaline phosphatase as indicator of bone formation. Clin Chem Acta 1991; 201: 27-34. 14. Withold W., Schulte U., Reinauer H. Method for determination of bone alkaline phosphatase activity: analytical performance and clinical usefulness in patients with metabolic and malignant bone diseases. Clin Chem 1996; 42: 2: 210-217. |