Синдром андрогенной недостаточности как маркер техногенного загрязнения среды обитания.
|
Одной из заметных глобальных демографических тенденций второй половины XX в. явилось ухудшение показателей состояния репродуктивного здоровья. По данным, представленным в документах Встречи на высшем уровне в рамках Конференции ООН по окружающей среде и развитию (1992), в период с 1960 по 1990 г. коэффициент фертильности снизился в 1,5 раза [1]. По мнению ведущих аналитиков, причина заключается не столько в росте населения, сколько в общем снижении мужской плодовитости. Анализ причин бесплодия обнаруживает рост удельного веса мужского фактора - за последние 20 лет он увеличился в среднем на 10-12%, продолжает расти и мужское бесплодие встречается столь же часто, как и женское.
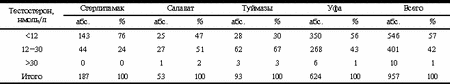
Интерес к репродуктивному здоровью мужчин был вызван также появлением многочисленных сообщений о снижении количественных и качественных характеристик спермы и учащении случаев патологии мужской половой сферы в конце ХХ в. [2, 3]. В настоящее время общепринятой является гипотеза об экологической обусловленности нарушения репродуктивного здоровья мужчин [4]. В течение длительного исторического периода изменения, вызываемые поступлением в окружающую среду различных поллютантов, относительно легко компенсировались естественными процессами: природа с помощью барьерных механизмов предохраняла основные органы и функции, в первую очередь органы размножения и функцию воспроизводства себе подобных. Однако в современных условиях человечество подвергается воздействию сложного комплекса агрессивных факторов внешней среды, абсолютное большинство которых имеет антропогенное происхождение. В результате сложилась так называемая "токсическая ситуация", когда накоплениехимических веществ приобрело лавинообразный характер: к исходу XX в. в биосфере циркулировало около 4 млн токсичных веществ; 100 тыс. ксенобиотиков попадает в организм человека, более 1000 из них обладают свойствами репротоксикантов; около 50% генофонда жителей Европы не воспроизводится в последующих поколениях. В итоге появляются новые, доселе неизвестные формы заболеваний - так называемые "экологические", приводящие в ряде регионов к нарастанию явлений депопуляции. Несмотря на значительные компенсаторные резервы функциональных систем человека, благодаря которым их нарушения проявляются лишь при достаточно интенсивных воздействиях, защитные механизмы организма все чаще утрачивают способность противостоять давлению экотоксикантов, вследствие чего происходит их дезадаптация и поломка. В этих условиях одной из наименее защищенных и наиболее уязвимых в организме оказалась репродуктивная система. В связи с этим была сформулирована концепция о репродуктивном здоровье человека как интегральной функции состояния окружающей среды и чувствительном индикаторе экологического неблагополучия [5]. Среди различных факторов среды обитания особую роль играет большая группа соединений с эстрогеноподобными или антиандрогенными эффектами, которые нарушают сперматогенез и андрогенопоэз вследствие вмешательства в механизмы их регуляции или прямого цитотоксического действия. Например, в образцах обыкновенной сажи обнаружена эстрогенная активность, сопоставимая с активностью сыворотки крови беременной женщины [6]. Сыворотка крови и эякулят мужчин, жителей Центральной Европы, также обладают повышенной эстрогенной и даже диоксиноподобной активностью [7]. Вместе с тем прямые доказательства взаимосвязи состояния окружающей среды и ключевых параметров репродуктивной функции мужчин практически отсутствуют. Имеются единичные работы [8], посвященные анализу влияния экотоксикантов на мужскую репродуктивную систему, выполненные на небольших группах обследуемых и на протяжении ограниченного периода времени. Поэтому целью настоящего исследования явилась оценка в динамике андрогенного статуса мужчин, жителей городов Республики Башкортостан (РБ) с высоким уровнем техногенной нагрузки. Материал и методы Обследовано около 1000 человек репродуктивного возраста, проживающих в Уфе, Стерлитамаке, Салавате и Туймазах. Была сформирована группа наблюдения, однородная по материально-бытовым условиям, обеспеченности медицинской помощью, продолжительности проживания в данном районе (не менее 3 лет), а также по состоянию здоровья и социальному положению. Из числа обследованных были исключены мужчины, имевшие в анамнезе заболевания яичек и их придатков, перенесшие оперативные вмешательства на органах мошонки, паховых каналах и сосудах яичка. У всех обследованных исключено варикоцеле. Об андрогенном статусе судили по содержанию в сыворотке крови тестостерона. У отдельной группы мужчин измеряли уровень эстрадиола, ЛГ, ФСГ, пролактина, АКТГ, кортизола и ДГЭА сульфата. Содержание гормонов определяли с помощью стандартизованных тест-систем на ИФА-анализаторе "Anthos-2020". Сыворотку крови замораживали до проведения исследования при -20 °С. Статистическую обработку результатов осуществляли с помощью параметрических методов анализа с использованием парного критерия Стьюдента. Результаты Обследованы мужчины в возрасте 32,4±2,9 года с массой тела в среднем 76,1±3,7 кг и ростом 174,8±5,1 см, т.е. в пределах физиологической нормы. Существенных различий данных показателей в разных городах не обнаружено. Таблица 1. Концентрация тестостерона в крови и средний возраст мужчин в различных городах РБ
Определение базального уровня тестостерона у мужчин в индустриальных городах РБ выявило ряд закономерностей, главной из которых является выраженная тенденция к гипоандрогенемии как во всей совокупности, так и в отдельных группах обследованных пациентов в различных городах (табл. 1). Наиболее низкий уровень тестостерона у мужчин обнаружен в Стерлитамаке и Уфе, где он статистически значимо отличался от средних сывороточных концентраций у пациентов, проживающих в Туймазах и Салавате. Анализ полученных данных свидетельствует о том, что снижение содержания тестостерона носит не относительный, а преимущественно абсолютный характер. В табл. 2 представлено распределение обследованных мужчин по отношению концентрации тестостерона к референтным пределам его уровня, указанным в инструкциях, прилагаемым к тест-системам. Для большинства обследованных лиц (57%) характерен абсолютный андрогенный дефицит, т.е. уровень общего тестостерона в сыворотке крови ниже 12 нмоль/л. Степень абсолютной андрогенной недостаточности колеблется от 30% в относительно благополучных Туймазах до 76% в Стерлитамаке. Сопоставление этих данных с результатами известного исследования A. Vermeulen [9], обнаружившего признаки абсолютного андрогенного дефицита лишь у 1% здоровых мужчин данной возрастной группы (20-40 лет), одных районов, где расположены предприятия нефтепереработки и нефтехимии, статистически значимо ниже, чем у мужского населения более отдаленных южных районов (табл. 3). В противоположность этому, сывороточный уровень эстрадиола превышал показатели нормы как в среднем по городу, так и в группе мужчин, проживающих в районах, подверженных значительной техногенной нагрузке, что может свидетельствовать о демаскулинизирующей и феминизирующей направленности процессов перестройки эндокринной регуляции репродукции в условиях экологического напряжения. Таблица 2. Распределение мужчин по отношению концентрации тестостерона к референтным границам
Во всей изучаемой популяции концентрация гонадотропных гормонов (ЛГ и ФСГ) в сыворотке крови имела большие колебания и, что явилось неожиданной находкой, статистически значимо не различалась у мужчин разных групп. Низкий уровень андрогенов в обычных условиях стимулирует выброс гонадотропинов гипофиза по механизму отрицательной обратной связи. Очевидно, этот универсальный способ регуляции гонадостата оказывается недостаточно эффективным и несостоятельным, что не позволяет стабилизировать функцию семенников при воздействии экотоксикантов. Особенностью состояния гипофизарно-надпочечниковой системы мужчин в Уфе явилась диссоциация уровня АКТГ и кортизола. В наиболее неблагополучных районах содержание кортикотропина в 2,3 раза, а в более "чистом" - в 1,8 раза превышало нормальные значения (р < 0,05), в то время как колебания концентрации кортизола не были статистически значимыми ни в одной из исследуемых групп. По-видимому, указанные изменения в системе гипоталамус - гипофиз - надпочечники у населения города с развитой химической промышленностью отражают тенденции адаптационных реакцийнозначно указывает на высокую вероятность развития у обследованного нами контингента лиц отклонений физиологически нормального состояния репродуктивной системы.
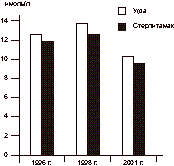
Ретроспективный анализ содержания андрогенов свидетельствует о неслучайном характере выявленных изменений: во все сроки наблюдений был обнаружен стабильно низкий уровень тестостерона у мужчин в двух наиболее проблемных городах - Уфе и Стерлитамаке (см. рисунок). Для уточнения особенностей андрогенного статуса мужчин в экологически неблагополучном регионе нами было предпринято углубленное обследование жителей Уфы, проживающих в районах города с различной техногенной нагрузкой. Выделены две группы наблюдения: 1-ю группу составили 127 человек из северных, самых экологически напряженных районов Уфы, во 2-ю группу вошли 108 мужчин из относительно "чистых", южных районов. По нашим данным, степень гипотестостеронемии в пределах одной территории находится в прямой зависимости от близости к источникам загрязнения: уровень гормона у жителей северорганизма в условиях хронического воздействия факторов техногенного происхождения невысокой интенсивности. Повышение содержания АКТГ у жителей Уфы при близкой к норме концентрации кортизола свидетельствует о развитии напряжения в центральном - гипофизарном звене (начальная адаптационная стадия - тревоги). Таблица 3. Содержание гормонов в сыворотке крови мужчин в различных районах Уфы
Примечание. I - мужчины из северных районов Уфы; II - мужчины из южных районов Уфы; III - Уфа в целом; IV - усредненные данные литературы [8, 9-13]. Звездочками отмечена достоверность результатов p < 0,05: * - в сравнении с IV, ** - в сравнении со II. Степень тревожных ожиданий может отражать и секреция пролактина, также причастного к адаптационно-приспособительным механизмам. По нашим данным, повышенный фон загрязнения севера Уфы приводит к гиперпролактинемии, достигающей 180% по отношению к контрольным величинам. Концентрация основного представителя надпочечниковых андрогенов - ДГЭА-С не претерпевала значимых изменений и оставалась на высоком уровне у мужчин обеих групп. Отсутствие взаимосвязи содержания яичковых и надпочечниковых андрогенов представляется вполне закономерным, поскольку регуляция выделения мужских половых гормонов различного происхождения осуществляется двумя относительно независимыми механизмами [11]. В целом гормональный профиль у мужчин, жителей промышленной зоны Уфы, соответствует картине нормогонадотропного гипогонадизма. На основании этих результатов мы пришли к заключению о возможности развития синдрома андрогенной недостаточности в экологически неблагополучных регионах. Обсуждение Гипотеза о существенной роли факторов внешней среды в ухудшении показателей репродуктивного здоровья мужчин не противоречит основным постулатам экологической эпидемиологии по Хиллу (биологическое, географическое, временное правдоподобие, специфичность и др.) [14]. Справедливость принципа географического правдоподобия применительно к рассматриваемой теме иллюстрируют, в частности, полученные нами данные. Результаты долговременных наблюдений демонстрируют, что для РБ характерно многолетнее поступление в окружающую среду диоксинов, ПХБ и других стойких органических загрязнителей (СОЗ). Острота проблемы обусловлена тем, что в республике находятся крупнейшие предприятия по производству хлорорганических соединений. Суммарные выбросы диоксинов в 1990 г. только на одном уфимском предприятии составили около 900 г. В настоящее время поступление диоксинов не превышает 50 г/год. Несмотря на это, содержание диоксинов в крови жителей Уфы продолжает нарастать, о чем свидетельствует увеличение концентрации этих соединений с возрастом. Так, у 20-25-летних жителей уровень диоксинов составляет 15-20 пг на 1 г липидов, а у 50-60-летних увеличивается до 50-60 пг/г, т.е. скорость поступления диоксинов в организм выше, чем скорость выведения [15]. В этих условиях "диоксиновая" угроза для населения промышленных городов республики представляется весьма реальной. Мы далеки от мысли, что единственной причиной обнаруженных изменений андрогенного статуса у мужчин выступает лишь воздействие СОЗ. Мы согласны с мнением большинства авторов, что андрогенная недостаточность является результирующей влияния комплекса различных факторов, включая, наряду с экологическими, социально-экономические, генетические, а также экзогенные интоксикации, не связанные с прямым воздействием окружающей среды: растущее потребление алкоголя, наркотиков, курение, аллергизация, широкий и бесконтрольный прием лекарственных препаратов и др. [10, 16, 17]. В этой связи нельзя не отметить, что одним из устоявшихся в обыденном сознании, да и в представлении многих специалистов, является тезис об особо высокой чувствительности женщин к неблагоприятным факторам внешней среды. Действительно, в базовых, стационарных условиях формируются стойкие половые различия метаболизма чужеродных соединений, они обезвреживаются более эффективно в мужском организме [18]. Однако для большинства ксенобиотиков показано, что индуцируемая реактивность энзиматических систем их детоксикации в экстремальных ситуациях у мужчин выражена значительно слабее, чем у женщин. Адаптивные возможности мужского организма невелики и истощаются быстрее, особенно в условиях длительного поступления экотоксикантов. Очевидно, что именно половая дифференциация метаболизма чужеродных соединений является предпосылкой различного поведения диоксинов в мужском и женском организме. Приведем лишь наиболее яркие иллюстрации этого тезиса. Расчетная кумулятивная доза диоксинов у высокоэкспонированных мужчин в 34 раза выше, чем у женщин, а период полувыведения равен 286 мес (у женщин - 146 мес) [19]. В этой же группе мужчин обнаружено увеличение содержания клеток, экспонирующих белок CD95 - маркер апоптоза, что отражает феномен ускоренного старения организма. В то же время гипотестостеронемия у мужчин, контактирующих с диоксинами, индуцирует смещение соотношения их потомства в сторону преобладания женского пола [20], т.е. феминизирующее влияние диоксинов проявляется не только на организменном, но и на популяционном уровне, а сегрегация полов происходит уже на этапе оплодотворения. Диоксины и диоксиноподобные соединения являются также индукторами цитохрома Р450. Эти цитохромы, как правило, инактивируют ксенобиотики. Коварство же диоксинов и других СОЗ заключается в том, что они стимулируют через посредничество арилуглеводородного рецептора (АhR) именно токсифицирующую изоформу цитохромов - CYP4501A1, с чем связаны мутагенез, канцерогенез, изменение метаболизма половых стероидных гормонов и др. В контексте нашего сообщения очень важно, что экспрессия гена AhR отмечается в органах мужской репродуктивной системы, но не женской [21]. Таким образом, учитывая собственные и литературные данные и принимая во внимание масштабы применения СОЗ, их способность к легкому распространению, устойчивость в биосфере и кумулятивные свойства, можно утверждать, что соединениям этого класса может принадлежать важная роль в генезе нарушений мужской репродуктивной функции. Ш.Н. Галимов, Ф.Х. Камилов, Э.Ф. Аглетдинов, Д.С. Громенко1, Х.Г. Валеева1,А.П. Голощапов, В.И. Иваха Башкирский государственный медицинский университет, Республиканский центр планирования семьи и репродукции1, Уфа Литература 1. Программа действий. Встреча на высшем уровне "Планета Земля". Повестка дня на XXI век и другие документы конф. ООН по окружающей среде и развитию (Рио-де-Жанейро, 1992). Женева: Кундиг 1993; 70. 2. Быков В.Л. Сперматогенез у мужчин в конце ХХ века. Пробл репрод 2000; 1: 6-13. 3. Comhaire F., Van Waeleghem K., De Clercq N. Declining sperm quality in European men. Andrologia 1996; 28: 300-301. 4. Schuhler P. Fertilite masculine: Lўenvironnement mis en cause. Concours Med 1997; 119: 2425. 5. Измеров Н.Ф., Сивочалова О.В., Денисов Э.И. Медико-социальные проблемы охраны репродуктивного здоровья и пути их решения. Материалы международного симпозиума "Актуальные проблемы репродуктивного здоровья в условиях антропогенного загрязнения". Казань: Арт-кафе 2001; 5-13. 6. Rehmann K., Schramm K.-W. Soot as a estrogen- and androgen receptor activating compounds. Organohal Comp 1999; 42: 105-108. 7. Machala M., Vondracek J., Ulrich R. et al. Evidence for estrogenic and TCDD-like activities in extracts of blood and semen of men. Organohal Comp 1999; 42: 83-86. 8. Goncharov N., Nizhnik A., Dobracheva A. et al. Dioxin impact on male reproductive system in Samara region of Russia. Organohal Comp 1999; 42: 61-65. 9. Vermeulen A. Some reflections on the endocrinology of the aging male. Aging male 1998; 1: 163-168. 10. Гончаров Н.П., Кация Г.В., Колесникова Г.С. и др. Состояние репродуктивной функции у мужчин - участников ликвидации последствий аварии на Чернобыльской АЭС. Пробл эндокринол 1998; 4: 25-28. 11. Корякин М.В., Акопян А.С., Васильев В.И. О взаимосвязи андрогенов яичек и надпочечников при гипогонадизме. Пробл эндокринол 1998; 1: 27-30. 12. Кулаков В.И., Леонов Б.В., Фанченко Н.Д. и др. Состояние репродуктивной системы супружеских пар, включенных в программу ЭКО. Пробл репрод 1998; 3: 55-58. 13. Спицын В.А., Бец Л.В., Аникеева А.В. Влияние средовых и генетических факторов на уровни тестостерона, эстрадиола и соматотропного гормона у горцев Памира. Вестник РАМН 1997; 7: 46-50. 14. Ревич Б.А. Загрязнение окружающей среды и здоровье населения. Введение в экологическую эпидемиологию. М: МНЭПУ 2001; 264. 15. Майстренко В.Н. Итоги выполнения республиканской программы "Диоксин" в Республике Башкортостан. Материалы Всероссийской конференции "Диоксины и родственные соединения: экологические проблемы и методы контроля". Уфа 2001; 15-22. 16. Руководство по андрологии. Под ред. О.Л. Тиктинского. Л: Медицина 1990; 416. 17. Peltola V., Mantyla E., Huhtaniemi I., Ahotupa M. Lipid peroxidation and antioxidant enzyme activities in the rat testis after cigarette smoke inhalation or administration of polychlorinated biphenyls or polychlorinated naphthalenes. J Androl 1994; 15: 353-361. 18. Розен В.Б., Матарадзе Г.Д., Смирнова О.В., Смирнов А.Н. Половая дифференцировка функций печени. М: Медицина 1991; 336. 19. Курчатова Н.Н., Сибиряк С.В., Амирова З.К. и др. Последствия длительного воздействия полихлорированных дибезодиоксинов и дибензофуранов (ПХДД/ДФ) на иммунную систему у высокоэкспонированных мужчин. Факторы здоровья мужчин. Под ред Р.Ш. Магазова. Уфа: БЦМП МЗ РБ 2000; 103-108. 20. James W. The sex ratio of offspring sired by men exposed to wood preservatives contaminated by dioxin. Scand J Work Environm Health 1997; 23: 69. 21. Yonemoto J., Jana R., Sarkar S. et al. Expression of dioxin-related genes in response to 2,3,7,8-TCDD in various tissues of rats. Organohal Comp 1998; 37: 217-220. - Доктор, у меня болит голова, а в остальном я полностью здорова: аппетит, как у тигра, на работе вкалываю, как лошадь, дома верчусь, как белка в колесе, сплю, как сурок, все заживает на мне, как на собаке. - Может быть, вам стоит обратиться к ветеринару?
|