Профилактика тромботических осложнений у пациенток с синдромом гиперстимуляции яичников.
|
Частота развития тяжелых форм синдрома гиперстимуляции яичников (СГЯ) в циклах вспомогательных репродуктивных технологий (ВРТ) колеблется от 0,2 до 9% [6, 7]. СГЯ возникает как следствие неконтролируемого ответа яичников на введение гонадотропинов. Клиническая картина этого ятрогенного заболевания характеризуется высокой концентрацией стероидных гормонов в плазме крови, увеличением размера яичников с формированием фолликулярных и лютеиновых кист, нарушением сосудистой проницаемости с массивным выходом жидкости в третье пространство, что обусловливает формирование полисерозитов, развитие диспротеинемической гиповолемии и гемоконцентрации, ведущих к нарушению микроциркуляции и полиорганным нарушениям [6, 7].
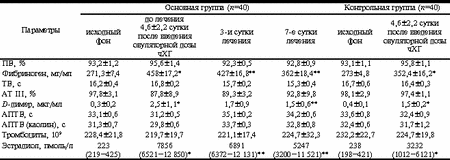
Несмотря на отсутствие в доступной литературе официальных данных о частоте тромботических и тромбоэмболических осложнений при СГЯ, не вызывает сомнения, что тромбозы магистральных сосудов и тромбоэмболия легочной артерии являются самыми серьезными осложнениями при тяжелых формах СГЯ и наиболее частыми причинами летальных исходов у данного контингента больных [11-13]. Венозные тромбозы преобладают в структуре тромботических осложнений, достигая 75%. Наиболее часто поражаются глубокие вены нижних конечностей, яремные, подключичные, а также нижняя полая вена. Артериальные тромбозы встречаются несколько реже, составляя около 25%. В патологический процесс могут вовлекаться церебральные, вертебральные, подключичные, сонные, феморальные, мезентериальные артерии, легочная артерия, аорта. В литературе описаны случаи артериальных тромбозов, закончившиеся ампутацией конечности, а также развитие гемиплегии на фоне ишемического инсульта [11-13]. С нарушением микроциркуляции и динамической ишемией головного мозга связывают неврологические симптомы у пациенток с СГЯ, проявляющиеся головными болями, головокружениями, парестезиями [7]. Патогенетические механизмы развития СГЯ и формирования тромбофилии при этом ятрогенном заболевании многофакторны и нуждаются в дальнейшем изучении. Однако не вызывает сомнения, что в комплекс лечебных мероприятий у пациенток с СГЯ целесообразно включать антитромботические препараты, наиболее патогенетически обоснованными из которых являются низкомолекулярные гепарины (НМГ) [8, 10]. Целью исследования явилась оценка эффективности применения НМГ фрагмина для профилактики тромбоэмболических осложнений у пациенток с СГЯ. Материал и методы В исследование включены 40 пациенток с СГЯ, развившимся на фоне индукции суперовуляции в программах ВРТ. Контрольную группу составили 40 женщин с индукцией суперовуляции в программах ВРТ без клинических симптомов СГЯ. Средний возраст больных исследуемой группы составил 34,4±5,2 года при длительности бесплодия 5,9±4,1 года. Всем пациенткам до включения в программы ВРТ было проведено комплексное клинико-лабораторное обследование, в результате которого были изучены клинико-анамнестические данные, характер менструально-репродуктивной функции, показатели инфекционного и гормонального скринингов, данные ультразвукового исследования органов малого таза (УЗИ) и результаты гистеросальпингографии (ГСГ). При манифестации клинических симптомов СГЯ проводили дополнительное динамическое клинико-лабораторное обследование, которое включало изучение клинической картины заболевания, УЗИ органов брюшной и грудной полостей, а также малого таза. Оценивали показатели гематокрита, лейкоцитов и содержание белковых фракций в плазме крови. Динамически оценивали следующие параметры гемостаза: протромбиновое время (ПВ), тромбиновое время (ТВ), активированное парциальное тромбопластиновое время (АПТВ), концентрацию фибриногена и D-димера, уровень антитромбина III, количество тромбоцитов, анти-Xа активность низкомолекулярного гепарина. Определение этих показателей проводилось в цитратной плазме на автоматическом анализаторе гемостаза STA Compact («Diagnostica Stago», Франция) клоттинговым и хромогенным методами. Исследовали образцы крови, полученные у пациенток перед началом стимуляции (в раннюю фолликулиновую фазу цикла), при манифестации симптомов СГЯ, а также на 3-и и 7-е сутки комплексной терапии с применением НМГ Фрагмин «Фармация». Фрагмин вводили подкожно в дозе 100-150 анти-Xа МЕ/кг 2 раза в сутки. Эффективность терапии оценивали по динамическому снижению концентрации D-димера в плазме крови. Разовую дозу препарата подбирали индивидуально в зависимости от массы тела пациентки и уровня анти-Ха активности плазмы. Поддерживали безопасную терапевтическую концентрацию препарата в диапазоне 0,2-0,4 анти-Ха. Кровь для исследования забирали через 3 ч после инъекции фрагмина. Длительность терапии НМГ была индивидуальной для каждой пациентки и зависела от показателей тромбинемии в плазме крови. Критерием отмены препарата являлась нормализации уровня D-димера. Статистическая обработка проведена с помощью программы "Статистика" с использованием коэффициента Стьюдента; гормональные параметры проанализированы с использованием модели лог-нормального распределения. Результаты исследования При анализе клинико-анамнестических данных пациенток основной группы отмечено, что в течение 4,8±3,7 лет женщинам проводились различные виды медикаментозной терапии, включая гормональную, направленные на восстановление репродуктивной функции. В среднем каждой пациентке было произведено 2,1±0,4 безуспешных попыток ЭКО и ПЭ. Регулярный ритм менструаций имели 81% женщин, нарушение по типу олигоменореи - 19%. Частота первичного бесплодия составила 67,8%, вторичного - 32,2%. Показаниями к индукции суперовуляции в программе ВРТ служили трубно-перитонеальное бесплодие - у 62% пациенток, наружный генитальный эндометриоз - у 33%, ПКЯ - у 19%. В 29% случаев включение в программу ЭКО и ПЭ было обусловлено мужскими причинами бесплодия. У 3% супружеских пар причина нарушения репродуктивной функции после проведения комплексного клинико-лабораторного и эндоскопического обследования, включая патоморфологическое исследование эндометрия, не была установлена. При клиническом обследовании отмечено, что массоростовой показатель у 90,9% женщин соответствовал нормативным параметрам, а у 9,1% пациенток с ПКЯ и нарушением менструального цикла по типу олигоменореи превышал 24,2. Варикозное расширение вен нижних конечностей выявлено у 11,2% женщин. Для индивидуального подбора схемы индукции суперовуляции проведен анализ гормональ ных параметров в зависимости от характера менструальной функции, который показал, что у всех пациенток с регулярным ритмом менструаций концентрации гонадотропных и стероидных гормонов в плазме крови не отличались от нормативных показателей. Транзиторное повышение уровня пролактина (ПРЛ) отмечено у 7,3% женщин с наружным генитальным эндометриозом. Изучение особенностей гонадотропной функции гипофиза у пациенток с олигоменореей выявило достоверное увеличение индекса ЛГ/ФСГ (3,1±0,5) и снижение уровня эстрадиола (Е2) до 189 (98-140) пмоль/л, p < 0,05. В 11,5% случаев изменение секреции гонадотропинов и снижение уровня эстрогенной насыщенности организма сопровождалось увеличением концентрации тестостерона 3,1 (2,9-3,8) нмоль/л в плазме крови. Манифестация симптомов СГЯ у 40 пациенток основной группы отмечена в среднем на 4,6±2,2 сутки после введения овуляторной дозы хорионического гонадотропина (чХГ). Результаты клинического обследования указали на наличие гастроинтестинальных симптомов (тошноту, рвоту, вздутие живота, боли в нижних отделах живота) и признаки гиповолемии (гипотензию, тахикардию, сухость кожных покровов) у всех женщин. Описанные клинические симптомы сопровождались увеличением диаметра яичников по данным УЗИ в среднем до 9,7±2,3 см с формированием в них множества лютеиновых и фолликулярных кист, наличием асцита и задержкой жидкости в организме (отрицательным суточным диурезом). Выпот в плевральной полости диагностирован у 12% женщин по данным УЗИ. Головные боли различной интенсивности отмечали 89,4% женщин, головокружение - 39,7%, мелькание мушек перед глазами - 31,4%, ухудшение памяти и рассеянность внимания - 17,9%. Выраженность клинических симптомов СГЯ коррелировала с данными лабораторных показателей (r = 0,74), которые свидетельствовали о явлениях гемоконцентрации (гематокрит 47,1±0,6%, лейкоциты 11,8±1,6·109) и гипопротеинемии (белок плазмы крови 51,4±0,5 г/л) на фоне высокой концентрации Е2 в плазме крови, которая составила в среднем 7865 (6521-12 850) нмоль/л, p < 0,05 по сравнению с контрольной группой. Сравнительный анализ гемостазиологических параметров у пациенток основной и контрольной групп выявил более выраженные изменения свертывающей системы крови при манифестации симптомов СГЯ. Данные, представленные в таблице, указывают, что ПВ, ТВ, АПТВ и АТ III у пациенток основной и контрольной групп в программе ЭКО и ПЭ достоверно не изменялись. В то же время в процессе реализации программы ЭКО и ПЭ возрастали концентрации фибриногена и D-димера по сравнению с исходными данными у женщин обеих групп, причем эти показатели в основной группе на 4,6±2,2 день после введения овуляторной дозы чХГ были достоверно выше, чем в контрольной. Комплексная терапия при СГЯ была направлена на коррекцию гиповолемии и гемоконцентрации, нормализацию почечного кровотока, восполнение потерь белка. Обоснованием к проведению антитромботической профилактики препаратом фрагмин явились приобретенные тромбофилические сдвиги в системе гемостаза, на фоне снижения объема циркулирующей плазмы (ОЦП), гемоконцентрации и высокого уровня Е2 в плазме крови. Применение фрагмина в суточной дозе 10 000-15 000 анти-Ха МЕ/сут позволило стабилизировать показатели гемостазиограммы и к 7-м суткам лечения уменьшить уровень тромбинемии и фибринемии в плазме крови. Динамика снижения концентраций фибриногена и D-димера на фоне терапии фрагмином представлена в таблице. К 7-м суткам лечения отмечено достоверное снижение указанных показателей по сравнению с лабораторными данными на момент манифестации клинических симптомов СГЯ. Количество тромбоцитов не изменялось по сравнению с исходными показателями. Длительность применения фрагмина была индивидуальной для каждой пациентки и составила в неэффективных циклах в среднем 8,1±2,9 дня, а в циклах с наступившим зачатием 17,8±4,8 дней. В нашем исследовании не было отмеченогеморрагических и аллергических осложнений при использовании НМГ. Обсуждение Основным патогенетическим механизмом, ведущим к тромботическим осложнениям у пациенток с СГЯ, являются гематологические нарушения, возникающие в результате активации системы ренин-ангиотензин и массивного выхода жидкости в третье пространство. Гемоконцентрация, гиповолемия, высокая осмолярность крови на фоне увеличения концентраций стероидных гормонов, цитокинов, вазоактивных субстанций, гистамина и простагландинов формируют тромбофилический статус у данного контингента больных [6, 7]. В подавляющем большинстве случаев компенсаторные возможности организма молодых женщин и инфузионная терапия коллоидно-кристаллоидными растворами помогают избежать опасных осложнений. Однако у пациенток с наследственными, или генетическими, а также иммунными формами тромбофилий суммарное воздействие указанных повреждающих факторов, как правило, приводит к серьезным тромботическим и тромбоэмболическим осложнениям, ведущим к инвалидизации и таящим в себе опасность летальных осложнений у молодых женщин, леченных всего лишь по поводу бесплодия [1]. В связи с вышеизложенным представляется вполне обоснованным динамический контроль показателей гемостаза у пациенток с СГЯ и необходимость проведения антитромботической профилактики, показанием к которой является активация коагуляционного потенциала крови. Наиболее чувствительным скрининговым маркером активации внутрисосудистого свертывания крови является концентрация D-димера [2]. D-димер - конечный продукт деградации фибрина. Его определение позволяет выявить активацию процессов свертывания крови, оценить уровень тромбинемии, а также эффективность и длительность антитромботической профилактики и терапии. Наряду с изложенным уровень D-димера позволяет охарактеризовать интенсивность патологических процессов, протекающих с фибринолизом. Параметры гемостаза у пациенток с СГЯ и женщин контрольной группы
Примечание. * - p < 0,05 по сравнению с исходным фоном; ** - p < 0,05 между параметрами на 4,6±2,2 сутки введения овуляторной дозы чХГ и на фоне лечения. Определение фибриногена в плазме крови является наиболее широко применяемым в клинической практике тестом, позволяющим оценить не только нарушения системы гемостаза, но и диагностировать тяжесть воспалительных, иммунных деструктивных процессов, при которых возникает гиперфибриногенемия как острофазовая реакция. Увеличение концентрации фибриногена у пациенток в программах ВРТ можно рассматривать как фактор риска сосудистых нарушений, так как фибриноген является предшественником фибрина - основного компонента кровяного сгустка и фокусной точкой коагуляционного каскада [2]. В последние годы препаратами выбора для профилактики и лечения тромботических осложнений в акушерско-гинекологической клинике являются НМГ, обладающие выраженной антитромботической активностью по сравнению с нефракционированным гепарином (НГ) [1, 3-5]. При использовании НМГ гораздо реже встречаются геморрагические осложнения и другие побочные эффекты, присущие НГ. Низкомолекулярный гепарин фрагмин (дальтепарин) получают методом деполимеризации и глубокой очисткой свиного гепарина. Фрагмин имеет молекулярную массу 4000-6000 дальтон. Активным веществом является дальтепарин натрия. Низкая молекулярная масса препарата обусловливает его фармакодинамические и фармакокинетические свойства: препарат обладает 100% биодоступностью, не связывается с различными острофазными белками, гораздо менее по сравнению с НФ взаимодействует с клетками эндотелия, более длительным периодом полужизни (14-16 ч). Фрагмин обладает в большей степени влиянием на Xa фактор (антитромботический эффект) и слабым влиянием на тромбин (антикоагулянтный эффект), в связи с чем значительно снижается риск геморрагических осложнений. Препарат менее подвержен влиянию антигепаринового фактора-4 тромбоцитов и таким образом реже вызывает гепарин-индуцированную тромбоцитопению, которая примерно в 30% случаев осложняется «рикошетными» тромбозами [1]. Фрагмин активирует фибринолиз, освобождая из эндотелия сосудов активатор плазминогена t-PA. В отличие от НГ не усиливает агрегацию тромбоцитов, так как способствует высвобождению из эндотелия антиагрегаторных субстанций [1, 3-5, 9]. Выраженный противотромботический эффект препарата связан с высвобождением ингибитора внешнего пути свертывания крови (ТFPI) [4]. Применение фрагмина для профилактики тромботических осложнений у пациенток с СГЯ является оправданным и эффективным. Уже на 3-и сутки использования препарата отмечено уменьшение активации внутрисосудистого свертывания. Фрагмин практически не повышает риск геморрагических осложнений и является более безопасным препаратом по сравнению с НГ. Выводы 1. Изучение параметров гемостаза у пациенток с СГЯ позволяет оценить риск развития тромботических осложнений. 2. Уровень D-димера в плазме крови отражает степень выраженности процессов активации внутрисосудистого свертывания крови. 3. Использование фрагмина для профилактики тромботических осложнений позволяет оптимизировать тактику ведения данного контингента больных и в короткие сроки улучшить показатели гемостазиограммы. 4. Маркером эффективности терапии НМГ является динамическое снижение концентрации D-димера в плазме крови. Критерием отмены НМГ служит нормализация уровня D-димера. И.Е. Корнеева, Н.Д. Фанченко, Б.В. Леонов, Т.Ю. Иванец, Д.П. Камилова Научный центр акушерства, гинекологии и перинатологии РАМН, Москва Литература 1. Баркаган З.С. Очерки антитромбической фармакопрофилактики и терапии. М 2000; 143. 2. Баркаган З.С., Момот А.П. Основы диагностики нарушений гемостаза. М 1999; 215. 3. Баркаган З.С. и др. В кн.: Сибирская научно-практическая конференция по актуальным вопросам фармакотерапии. Красноярск 1997; 60-61. 4. Бицадзе О.В., Макацария А.Д. Патогенетическое обоснование и возможности применения низкомолекулярных гепаринов в акушерской практике. Акуш и гин 1999; 2: 37-41. 5. Ольбинская Л.И., Гофман А.М. Лечение и профилактика тромбозов. М 2000; 195. 6. Bergh P.A., Navot D. Ovarian hyperstimulation syndrome: A review of pathophysiology. J Ass Reprod Genet 1992; 9: 429-438. 7. Haning R.V., Strawn E.Y., Nolten W.E. Pathophysiology of ovarian hyperstimulation syndrome. Obstet Gynecol 1985; 66: 220-224. 8. Hauer K.E. Low molecular weight heparin in the treatment of deep venous thrombosis. West J Med 1998; 169: 4: 240-244. 9. Feinstein D.I. Acquired disorders of hemostasis. In: Colman R.W., Hirsh J., Marder V.J. (eds). Haemostasis and Thrombosis: Basical Principles and Clinical Practice, 3 rd ed. Philadelphia: J.B. Lippincott 1994; 881-905. 10. Fourth Consensus Conference on Antithrombotic therapy. Dalen J.I., Hirsh J. (eds). Chest 1995; 108: 225-521. 11. Kaaja R., Sieberg R., Titinen A. Severe OHSS and deep venous thrombosis. Lancet 1989; 1043. 12. Mozes M., Bogokowsky H., Antebi E., Lunefeld B., Rabau E., Serr D., Salomy M. Tromboembolic phenomena after ovarian stimulation with human gonadotrophins. Lancet 1965; 1213-1215. 13. Rizk В., Meagher S., Fisher A. Severe OHSS and cerebrovascular accidents. Hum Reprod 1990; 5: 697-698. |