Динамика состояния молочных желез на фоне терапии ливиалом у женщин с мастопатией в постменопаузе.
|
Особенности репродуктивного поведения современных женщин (небольшое число родов, непродолжительная лактация, аборты) приводят к широкому распространению доброкачествен ной диффузной мастопатии, которая является одним из факторов риска развития рака молочной железы [1]. Клинические проявления мастопатии (масталгия, нагрубание молочных желез и др.) значительно снижают качество жизни женщин и являются причиной постоянного беспокойства в связи со страхом возможности развития рака молочной железы. С наступлением менопаузы в результате значительного снижения уровня половых гормонов фиброзно-кистозная мастопатия в большинстве случаев постепенно сменяется жировой или фиброзно-жировой инволюцией, что сопровождается исчезновением субъективных ощущений. Мастопатия не является противопоказанием к назначению заместитель ной гормонотерапии (ЗГТ), однако динамика состояния молочных желез на фоне ЗГТ у женщин с мастопатией изучена недостаточно и необходимо проведение дополнительных исследований с использованием различных типов ЗГТ.
Результаты проведенных исследований, показавшие тканеспецифическое действие ливиала [2], ингибирующее влияние препарата на клетки рака молочной железы in vitro [3], отсутствие увеличения рентгенологической плотности молочных желез на маммограммах [4, 25], позволили нам выбрать ливиал в качестве препарата ЗГТ для женщин с мастопатией в постменопаузе. Цель исследования Охарактеризовать влияние терапии ливиалом на течение мастопатии у женщин в постменопаузе. Материал и методы В исследование включены 22 женщины в постменопаузе (аменорея > 1 года или ФСГ > 40 МЕ/л), имевшие показания к назначению ЗГТ (климактерический синдром, остеопения и остеопороз, сердечно-сосудистая патология и др.) и предъявлявшие жалобы со стороны молочных желез (нагрубание, болезненность и др.). Для уточнения показаний и определения противопоказа ний к ЗГТ все пациентки исходно проходили клинико-лабораторное обследование, включавшее изучение анамнеза, биохимическое исследование крови с определением липидных фракций, гемостазиограмму, трансвагинальное УЗИ органов малого таза, цитологическое исследова ние мазков с шейки матки и из цервикального канала, остеоденситометрию, маммографию. В течение 12 мес все пациентки получали тиболон (Ливиал, Органон) по 2,5 мг в сутки. Состояние молочных желез оценивалось по субъективным ощущениям пациенток, при осмотре и пальпации, а также рентгенологическим методом. При оценке рентгенограмм молочных желез помимо традиционного описания определялась рентгенологическая плотность по классификации Wolfe [5, 6]. Выделяют 4 типа строения паренхимы молочных желез по Wolfe: — N1 — паренхима представлена полностью или почти полностью жировой тканью, единичные фиброзные соединительнотканные тяжи; — Р1 — протоковые структуры, занимающие не более 25% молочной железы; — Р2 — протоковые структуры занимают более 25% объема молочной железы; — DY — плотная (непрозрачная) паренхима ("дисплазия"), указывающая на гиперплазию соединительной ткани. Результаты Средний возраст женщин на момент назначения ЗГТ составлял 51,9 лет (от 39 до 63 лет), длительность менопаузы — 6,6 лет (от 2 до 10 лет). У 5 пациенток менопауза наступила в результате оперативного лечения: у 3 — по поводу миомы или миомы в сочетании с эндометрио зом, у 2 пациенток пангистерэктомия произведена в связи со злокачественными новообразо ваниями яичников — у одной пациентки в 1991 г. в возрасте 30 лет (папиллярная аденокарцинома яичников), у второй — в 1999 г. в возрасте 37 лет (серозная цистаденома яичников с началом малигнизации). Основными показаниями к назначению ЗГТ являлись: климактерический синдром (11 пациенток), снижение минеральной плотности костной ткани (8 пациенток), терапия и профилактика сердечно-сосудистой патологии (2 пациентки), профилактика урогенитальных нарушений (1 пациентка). При исходном обследовании все пациентки предъявляли жалобы со стороны молочных желез: периодическое ощущение нагрубания, болезненность в покое или при пальпации, чувство покалывания, жжения и др. Выраженность симптомов варьировала от слабой у 6 женщин до умеренной (у 12) и очень сильной (у 4). При исходном рентгенологическом обследовании молочных желез возрастная норма в виде полной фиброзно-жировой инволюции установлена у 4 пациенток (18%), остальные женщины имели признаки диффузных доброкачественных изменений молочных желез (см. табл. 1 и рис. 1). В течение 12 мес все пациентки получали ливиал с положительным эффектом в отношении менопаузальных нарушений. Побочных эффектов отмечено не было. Почти все женщины (20 из 22) отмечали значительное уменьшение нагрубания и болезненности молочных желез на фоне терапии ливиалом, из них 6 пациенток полностью перестали "ощущать" молочные железы.
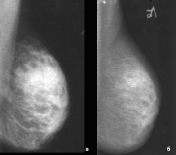
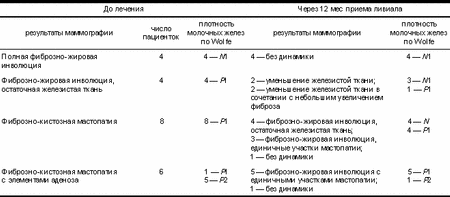
а — исходно, до лечения: фиброзно-кистозная мастопатия, Р2; б — через 12 мес терапии ливиалом: фиброзно-жировая инволюция, Р1. При анализе результатов рентгенологическо го исследования отрицательной динамики не установлено ни в одном случае, у 4 пациенток с исходной фиброзно-жировой инволюцией структура молочных желез не изменилась. У пациенток с исходной остаточной железистой тканью отмечено нарастание инволюции с уменьшени ем объема железистой ткани на фоне терапии ливиалом. Из 14 пациенток с мастопатией на исходных снимках только у одной отсутствовала положительная динамика, у остальных 13 пациенток через 1 год приема ливиала мастопатия сменилась фиброзно-жировой инволюцией с остаточной железистой тканью или единичными участками мастопатии. При анализе рентгенологической плотности молочных желез по Wolfe у 11 (50%) пациенток установлено снижение плотности, у остальных (11) рентгенологическая плотность не изменилась, увеличения плотности отмечено не было (табл. 2). Таблица 1. Состояние молочных желез до лечения и через 12 мес терапии ливиалом
Таблица 2. Динамика рентгенологической плотности паренхимы молочных желез по Wolfe
Большинство женщин предполагают продолжать прием ливиала после окончания исследова ния. Обсуждение Несмотря на большое число исследований, показавших высокую эффективность ЗГТ в отношении климактерического синдрома, остеопороза, сердечно-сосудистой патологии, увеличения продолжительности и повышения качества жизни, на противоположной чаше весов при принятии решения о приеме гормонов в постменопаузе остаются опасения возможного увеличения частоты рака молочной железы. Поскольку рак молочной железы является наиболее частым злокачественным новообразованием (заболевает приблизительно 1 из 10 женщин в экономически развитых странах [7]), даже небольшое увеличение частоты этой патологии затронет значительное число женщин. Учитывая значение маммографии в скрининге и ранней диагностике рака молочной железы, всем женщинам перед назначением ЗГТ, а также на фоне терапии необходимо проведение этого исследования. В отношении ливиала расчетов риска рака молочной железы по результатам эпидемиологи ческих исследований пока не представлено [8], однако экспериментальные и клинические исследования указывают на особое влияние терапии синтетическим стероидом ливиалом на молочные железы по сравнению с традиционным использованием натуральных эстрогенов в качестве ЗГТ. Установлено, что эстрогены не являются истинными канцерогенами для молочной железы, однако, усиливая пролиферативную активность клеток, они являются наиболее значимыми факторами, поддерживающими и ускоряющими рост опухоли [9, 10]. Несмотря на резкое снижение уровней циркулирующих эстрогенов в постменопаузе,
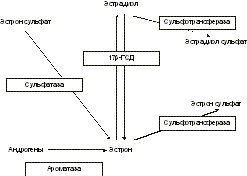
17b-ГСД — 17b-гидроксостероид-дегидрогеназа. концентрация последних в раковых клетках молочной железы одинакова в пре- и постменопау зе, что объясняется локальным синтезом эстрона и эстрадиола в молочной железе [3] (рис. 2). Синтез эстрогенов в ткани молочной железы осуществляется по двум основным путям: сульфатазному и ароматазному, при этом в раковых клетках сульфатазный путь по значимости в 50—500 раз превосходит ароматазный [3]. В эксперименте на культуре раковых клеток было показано, что тиболон и его метаболиты обладают выраженной антисульфатазной активностью, за счет чего ингибируют локальный синтез эстрадиола и тормозят пролиферацию [11] раковых клеток. In vivo тиболон и его метаболиты тормозили рост рака молочной железы у крыс [12, 13]. На основании экспериментальных данных, указывающих на антиэстрогенный эффект тиболона в отношении эпителиальных клеток молочной железы, высказываются даже предположения о возможности использования ливиала в лечении рака молочной железы [3, 11]. Однако пока в клинической практике ливиал применяют только в качестве ЗГТ. Известно, что начало приема эстроген-гес тагенной ЗГТ у 25—30% женщин в первые 3 мес может сопровождаться нагрубанием молочных желез и в некоторых случаях требует дополнительного назначения растительных гомеопатиче ских средств [14]. В нашем исследовании ливиал назначался женщинам, уже исходно предъявляв шим жалобы со стороны молочных желез, тем не менее, в течение года приема препарата ни в одном случае не было увеличения нагрубания или болезненности молочных желез без дополнитель ного назначения каких-либо препаратов. Более того, практически у всех пациенток с исходными изменениями молочных желез наблюдалась положительная динамика по данным маммографии в виде перехода фиброзно-кистозной мастопатии в фиброзно-жировую инволюцию, уменьшению объема железистой ткани. У 50% женщин отмечено уменьшение рентгенологиче ской плотности молочных желез, что сопровождалось значительным уменьшением субъективных ощущений. Полученные нами результаты согласуются с данными других авторов, изучавших рентгенологическую плотность молочных желез, оцененную по Wolfe, на фоне различных типов ЗГТ. Гистологические изменения паренхимы молочных желез, приводящие к увеличению рентгенологической плотности, до конца не ясны и требуют дальнейшего изучения. Существуют гипотезы, что высокая рентгенологическая плотность может быть обусловлена отеком, вазодилатацией, нарастанием фиброза, пролифераци ей эпителия [24]. В исследованиях Wolfe и других авторов [15—19] было показано, что существует связь между типами маммограмм по Wolfe и риском развития рака молочной железы у женщин старше 30 лет, при этом группа N1 имеет наименьший риск, группа DY — наибольший. Кроме того, увеличение рентгенологической плотности молочных желез затрудняет интерпретацию снимков и, тем самым, снижает чувствительность и специфичность маммографии в скрининге и диагностике рака молочной железы [20—22]. В исследовании Valdivia et. al. не отмечено увеличения рентгенологической плотности на фоне приема ливиала (n=30), эстриола (n=30) и плацебо (n=30) по сравнению с эстроген-гестаген ной ЗГТ (n=180), где рентгенологическая плотность молочных желез увеличилась у 23—67% пациенток в зависимости от препарата ЗГТ [4]. По результатам исследования PEPI (n=307) через 12 мес использования ЗГТ рентгенологи ческая плотность увеличивалась у 3,5% женщин, получавших монотерапию эстрогенами, у 23,5% получавших циклическую эстроген-гестагенную ЗГТ и 19,4% при непрерывной комбинирован ной ЗГТ, на фоне плацебо увеличения плотности не наблюдалось [23]. В 1999 г. группа шведских ученых опубликова ла данные об увеличении рентгенологической плотности молочных желез на фоне эстроген-гес тагенной ЗГТ (n=175): у 18% женщин при монотерапии эстрогенами, у 13% на фоне циклического режима и у 52% при непрерывном комбинированном режиме [24]. Erel et. al. в 2-летнем проспективном исследовании на фоне приема ливиала наблюдали незначительную отрицательную динамику только у 2 из 25 женщин — у одной увеличение рентгенологической плотности, у другой — появление микрокальцинатов. При использовании эстрогенов авторы отметили увеличение рентгенологи ческой плотности у 11—27% женщин [25]. В целом исследования показали, что рентгенологическая плотность молочных желез в постменопаузе может увеличиваться у части женщин, принимающих эстроген-гестагенную ЗГТ, и практически не изменяется или снижается на фоне ливиала или без ЗГТ. Для уменьшения нагрубания и болезненности молочных желез на фоне ЗГТ показано использование растительных гомеопатических средств [14]. Таким образом, особый эффект ливиала в отношении молочной железы, по-видимому, обусловлен влиянием препарата на метаболизм эстрогенов в ткани молочной железы. Результаты нашего исследования и данные литературы позволяют сделать предварительный вывод об обоснованности использования ливиала у пациенток с мастопатией в постменопаузе. Учитывая актуальность проблемы, необходимо также проведение дополнительных исследований. Заключение Жалобы на нагрубание и болезненность молочных желез в постменопаузе, как правило, являются своеобразными клиническими маркерами наличия мастопатии или остаточной железистой ткани, что подтверждается рентгеноло гическим исследованием. Терапия ливиалом в течение 12 мес приводит к значительному уменьшению субъективных ощущений и выраженной положительной динамике по данным рентгенологического исследования: уменьшению или исчезновению железистой ткани, нарастанию фиброзно-жировой инволюции, снижению рентгенологической плотности молочных желез. В проведенном исследовании не зарегистрировано случаев отрицательной динамики мастопатии или увеличения рентгенологической плотности молочных желез на фоне терапии ливиалом. Литература 1. Karagas M.R., Kelsey J., McGuire V. Cancers of the female reproductive system. In: Menopause: Biology and Pathobiology. Academic Press 2000. 2. Kloosterboer H.J. Tibolone and its metabolites: pharmacology, tissue specificity and effects in animal models of tumors. Gynec Endocrinol 1997; 11: Suppl 1: 63—68. 3. Pasqualini J.R., Chetrite G. Control of estrone sulfatase activity in human breast cancer cells: effect of tibolone and its metabolites. Gynec Endocrinol 1996; 11: Suppl 1: 69—75. 4. Valdivia I., Ortega D. Mammographic density in postmenopausal women treated with tibolone, estriol or conventional hormone replacement therapy. Clin Drug Invest 2000 Aug; 20:2: 101—107. 5. Wolfe J.N. Breast patterns as an index of risk for developing breast cancer. AJR Am J Roentgenol 1976; 126: 1130—9. 6. Wolfe J.N. Risk for breast cancer development determined by mammographic parenchymal pattern. Cancer 1976; 37: 2486—92. 7. Feuer E.J., Wun K.M., Bering C.C., Flanders W.D. et al. The lifetime risk of developing breast cancer. J Nat Acad Sci 1993; 85: 892—7. 8. Moore R.A. Livial: a review of clinical studies. Br J Obstet Gynaec 1999; 106; Suppl 19: 1—21. 9. Jackisch C., Schneider H.P.G. Biological effects of estrogen and prosestogen on human breast carcinogenesis. Menopause Rev 1997; 2: 1: 26—34. 10. Wren B.G. Hormone therapy following breast and uterine cancer. Bailliиre's Clin Endocrinol Metab 1993; 7:1: 225—42. 11. Gompel A., Kandouz M., Siromachkova M., Lombet A. et al. The effect of tibolone on proliferation, differentiation and apoptosis in normal breast cells. Gynec Endocrinol 1997; 11: Suppl 1: 77—79. 12. Chetrite G., Kloosterboer H.J., Philippe G.C. et al. Effects of Org OD14 (Livial) and its metabolites on 17b-hydroxysteroid dehydrogenase activity in hormone dependant MCF 7 and T 47D breast cancer cells. Anticancer Res 1999; 19: 261—7. 13. Kloosterboer H.J., Schoonen W.G.E.J., Deckers G.H. et al. Effects of progestagens and Org OD14 in in vitro and in vivo tumor models. J Steroid Biochem Mol Biol 1994; 49: 311—8. 14. Сметник В.П., Кулаков В.И. Руководство по климактерию. М 2001; 685. 15. Wolfe J.N., Saftlas A.F., Salane M. Mammographic parenchymal pattern and quantitative evaluation of mammographic dencities: a case control study. Am J Roentgenol 1987; 148: 1087—92. 16. Gravelle I.H., Bulstrode J.C., Wang D.I. et al. The relation between radiographic features and determinants of risk of breast cancer. Br J Radiol 1980; 53: 107—113. 17. Byrne C., Schairer C., Wolfe J. et al. Mammographic features and breast cancer risk: effects with time, age and menopausal status. J Natl Cancer Inst 1995; 87: 1622—9. 18. Carlile T., Kopecky K.J., Thompson D.J. et al. Breast cancer prediction and the Wolfe classification of mammograms. JAMA 1985; 254: 1050—3. 19. Gravelle I.H., Bulstrode J.C., Bulbrook R.D. et al. A prospective study of mammographic parenchymal pattern and risk of breast cancer. Br J Radiol 1986; 59: 487—491. 20. Laya M.B., Larson E.B., Taplin S.H. et al. Effect of estrogen replacement therapy on the specificity and sensitivity of screening mammography. J Natl Cancer Inst 1996; 88: 643—9. 21. Kavanagh A.M., Mitchell H., Giles G.G. Hormone replacement therapy and accuracy of mammographic screening. Lancet 2000; 355: 270—4. 22. Litherland J.C., Stallard S., Hole D. et al. The effect of hormone replacement therapy on the sensitivity of screening mammograms. Clin Radiol 1999; 54: 285—8. 23. Greendale G.A., Reboussin B.A., Sie A. et al. Effects of estrogen and estrogen progestin on mammographic parenchymal density. Postmenopausal Estrogen/Progestin Interventions (PEPI) Investigators. Ann Intern Med 1999; 130: 262—9. 24. Lundstrom E., Wilczek B., von Palffy Z. et al. Mammographic breast density during hormone replacement therapy: differences according to treatment. Am J Obstet Gynec 1999; 181: 348—52. 25. Erel C.T., Elter K., Akman C. et al. Mammographic changes in women receiving tibolone therapy. Fertil Steril 1998; 69: 870—5. В.П. Сметник, О.В. Новикова, Н.Ю. Леонова Москва Новый метод хирургического лечения недержания мочи при напряжении (TVT) В клинике урологии МГМСУ (на базе 50-й Городской клинической больницы) метод TVT применяется почти 3 года, выполнено более 250 операций. Полный эффект достигнут у 92%, эффекта не было у 5% больных. Свободная петля из пролена проводится из влагалища в надлобковую область через небольшие разрезы. Эффект удержания мочи обеспечивается поддержкой уретры петлей из пролена. Метод минимальноинвазивный, операция длится около 30 минут, выполняется под местным обезболиванием и позволяет выписать больную из стационара в кратчайшие сроки. Тел.: (095)109 4482, 979 5422 |