Оптимизация современных методов лечения генитального герпеса.
|
Актуальность проблемы выбора эффективно го метода лечения генитального герпеса (ГГ) обусловлена широким распространением герпетической инфекции, тяжестью течения заболевания и стойкой тенденцией к рецидивированию. Крайне важным представляется весомый вклад ГГ в развитие хронических воспалительных заболеваний мочеполовой системы, патологии беременности и его роль в структуре перинаталь ной смертности, увеличении в несколько раз риска развития рака шейки матки и риска заражения ВИЧ при серопозитивности по вирусу простого герпеса (ВПГ) типа 2 [1—4, 6, 10, 11].
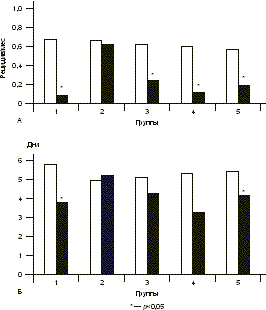
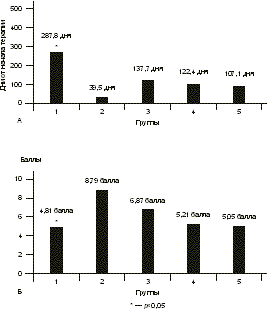
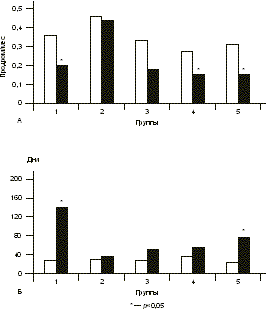
Основными задачами противогерпетической терапии являются ослабление клинических проявлений инфекции, предупреждение рецидивов и передачи инфекции половому партнеру и новорожденному [6—8]. Патогенетически обоснована терапия противовирусными химиопрепара тами — аналогами нуклеозидов, которые необратимо блокируют репродукцию ВПГ в пораженных клетках. Показаны высочайшая избиратель ность противогерпетического действия, отсутствие цитотоксических, тератогенных и мутагенных свойств и высокая клиническая эффективность препаратов этой группы при герпетических инфекциях. Однако химиопрепараты не препятствуют рецидивированию латентной инфекции, нет данных о их воздействии на иммунный ответ организма, недостаточно сведений о возможности их длительного использования и, что особенно значимо, существуют определенные ограничения, связанные с их высокой стоимостью [9, 12]. Пожизненная персистенция герпесвирусов в организме человека и формирование специфического иммунодефицита, обусловленного дефектами функционирования лимфоцитов и моноцитов и нарушением продукции лимфокинов, делают целесообразным введение в комплекс лечения препаратов с иммуномодулирующими свойствами [5]. Однако их клинико-лабораторные эффекты изучены недостаточно, требуются индивидуальный подбор препаратов и динамическое наблюдение за основными показателями иммунитета в процессе терапии. Целью настоящего исследования было изучение эффективности разных схем терапии ГГ у женщин репродуктивного возраста. Материал и методы Под наблюдением находились 102 женщины с типичной формой ГГ (средний возраст 30,8±0,82 года). Критерии включения в исследование: репродуктивный возраст и тяжелое течение ГГ. Критерии исключения: беременные или женщины, кормящие грудью, нарушение функции почек (уровень креатинина >1,5 мг/дл или вычисленный клиренс креатинина < 30 мл/мин), нарушение функции печени (уровень аланинами нотрансферазы более чем в 3 раза превышает норму), известная резистентность или гиперчувствительность к валацикловиру или другим препаратам, применяемым в исследовании, синдром мальабсорбции и известная непереносимость лактозы. Женщины 1-й группы (n=20) получали терапию валтрексом непрерывно по 500 мг/сут в течение 8 мес, 2-й группы (n=17) — плацебо по 500 мг/сут в течение 8 мес. В остальных группах проводилась комбиниро ванная терапия: после 4 мес терапии валтрексом по 500 мг/сут, что приводило к развитию стойкой контролируемой ремиссии и соответствовало в среднем двукратному увеличению длительности межрецидив ных промежутков, в фазе клинико-иммунологической ремиссии назначалась иммунотерапия. В 3-й группе (n=22) проводилась вакцинотерапия по 0,25 мл герпетической вакцины внутрикожно в сгибательную поверхность предплечья курсом 5 инъекций 1 раз в 3—4 дня и после интервала 7 дней еще 5 инъекций 1 раз в 7 дней. В случае развития рецидивов ГГ интервал между инъекциями увеличивали в 2 раза. Больным 4-й группы (n=21) назначали отечествен ный специфический противогерпетический иммуноглобулин по 0,3 мл внутримышечно 1 раз в 7 дней курсом 6 инъекций. В 5-й группе (n=22) проводилась иммунокоррекция с использованием препаратов и индукторов эндогенного синтеза интерферона, которые подбирались индивидуально. В качестве клинических критериев эффективности терапии в исследовании были использованы общее количество рецидивов ГГ на фоне лечения, время появления рецидива от начала терапии, продолжитель ность и тяжесть рецидивов, частота возникновения продромальных явлений на фоне терапии, длительность ремиссии после окончания лечения. Клинический эффект терапии оценивался как положительный в случае развития стойкой ремиссии или двукратного уменьшения частоты рецидивов ГГ на фоне лечения. При анализе полученных результатов выявлено, что стойкая ремиссия на фоне терапии отмечалась у 15 (75%) женщин 1-й группы (валтрекс), у 13 (61,9%) в 3-й группе (валтрекс и вакцина), у 16 (76,2%) в 4-й группе (валтрекс и иммуноглобулин) и у 18 (81,8%) в 5-й группе (валтрекс и препараты/индукторы интерферона). Полученные в этих группах результаты были сравнимы между собой (p>0,05) и достоверно отличались от данных 2-й группы (плацебо) — 0 (p<0,05). Частота возникновения рецидивов, являясь основным показателем тяжести ГГ, достоверно снижалась на фоне терапии в 1-й, 3-й, 4-й и 5-й группах (на 87,8% — p<0,0001; на 63,7% — p<0,0001; на 76,7% — p<0,001 и на 65,9% — p<0,001 соответственно по группам). Различия показателей между группами были статистически недостоверными (p>0,05), но достоверны ми в сравнении с группой плацебо — на 3,8% (p<0,05) (рис.1). Все зарегистрированные рецидивы инфекции при проведении комбинированной терапии (3—5-я группы) возникали на втором этапе лечения, т.е. по сле окончания приема валтрекса, что свидетельствует о выраженном противорецидивном эффекте химиотерапии. При рецидивах ГГ на фоне терапии во всех группах, кроме группы плацебо, отмечены уменьшение числа герпетических элементов, преобладание торпидных форм, уменьшение выраженности симптоматики и ускорение разрешения рецидивов по сравнению с периодом до лечения. Однако статистически достоверно длительность рецидивов ГГ на фоне лечения уменьшилась только в 1-й группе (с 5,9±0,5 до 3,8±0,48 дня, на 35,6% — p<0,05) и в 5-й (с 5,45±0,4 до 4,2±0,4 дня, на 22,9% — p<0,05) (см. рис. 1). При оценке показателя качества жизни по признаку «рецидивирующий ГГ» на фоне терапии наименее тяжелые рецидивы наблюдались на фоне лечения валтрексом в 1-й группе (4,81±3,5 балла), что было достоверно меньше показателей тяжести рецидивов в других группах (p<0,05). При лечении в 1-й, 4-й и 5-й группах показатель тяжести рецидивов оказался достоверно меньше, чем в группе плацебо (p<0,05). Важно отметить, что только при проведении комбиниро ванной терапии в 3-й группе (валтрекс и вакцина) тяжесть рецидивов стабильно оставалась выраженной (6,87±2,8 балла) и не отличалась от показателя в группе плацебо (p>0,05; рис. 2). Наиболее продолжительный период от начала терапии до развития рецидива отмечен у пациенток 1-й группы при лечении валтрексом — 287,8±27,1 дня, что достоверно превышало показатели в остальных группах (p<0,05). В группе плацебо данный показатель был в 7,3 раза меньше, чем в 1-й группе, и составил 39,5±11,2 дня (см. рис. 2). Частота продромальных явлений на фоне терапии статистически достоверно снизилась в 1-й (на 41,8% — p<0,05), в 4-й (на 47,4% — p<0,05) и в 5-й (на 53,8% — p<0,05) группах. При этом во 2-й и в 3-й группах изменения частоты продромальных явлений составили 2,7 и 40,3% соответственно и были статистически недостоверны (p>0,05; рис. 3). Наибольшее увеличение отношения продрома/рецидив отмечено в 1-й (от 0,51 до 2,45) и в 4-й (от 0,45 до 1,01) группах, при этом статистически достоверное увеличение отношения было отмечено и в 1-й, 4-й и 5-й группах (p<0,05). В группе плацебо величина отношения значительно не изменилась — от 0,67 до 0,68 (p>0,05).
А — время от начала терапии до развития рецидива ГГ; Б — оценка качества жизни по признаку "рецидивирующий ГГ" на фоне терапии.
Наиболее длительная ремиссия после отмены терапии наблюдалась в 1-й группе (валтрекс) — 142,2±23,5 дня, что достоверно отличалось от показателей в других группах (p<0,05). Длительность ремиссии в 3—5-й группе достоверно превышала данные в группе плацебо (p<0,05) и была достоверно меньше таковой в 1-й группе (p<0,05; см. рис. 3). Средняя длительность ремиссии до лечения и после отмены лечения статистически достоверно увеличилась в 1-й группе — в 5,4 раза (от 26,5±7,2 до 142,2±23,5 дня; p<0,05) и в 5-й группе — в 3,1 раза (от 24,4±3,9 до 74,8±20,2 дня; p<0,05). В остальных группах эти изменения были статистически недостовер ны: в 3-й группе длительность ремиссии увеличилась в 1,76 раза, в 4-й группе — в 1,5 раза (p>0,05). Результаты и обсуждение При суммировании полученных данных положительный клинический эффект терапии отмечен в большом проценте случаев в основных исследуемых группах (в 1-й группе — в 100% случаев, в 3-й — в 85,7%, в 4-й — в 90,5% и в 5-й — в 95,5%; в группе плацебо — 0; p<0,05). Однако мо нотерапия валтрексом (1-я группа) и комбинированная терапия с использованием препаратов и индукторов интерферона (5-я группа) достоверно чаще дают положительный клинический эффект (p<0,05), следовательно, их можно рассматривать как наиболее клинически эффективные методы терапии ГГ. Интересными для анализа представляются изменения, выявленные на фоне терапии в системе интерферона (ИФН). На фоне монотерапии валтрексом в 1-й группе и комбинированной терапии в 4-й и 5-й группах выявлено достоверное снижение уровня сыворочного ИФН в сыворотке крови на 64, 50 и 58,3% соответственно по сравнению с показателями до лечения. На фоне комбинированной терапии в 3-й группе отмечалась тенденция к повышению уровня сывороточ ного ИФН и дальнейшему снижению индуцированной продукции ИФН в лимфоцитах. Важно отметить, что в ходе лечения в 1-й, 4-й и 5-й группах восстанавливалась до нормативных показателей индуцированная продукция ИФН-a, ИФН-b и ИФН-g в лейкоцитах, что свидетель ствует о восстановлении потенциальной способности системы ИФН отвечать на антигенные воздействия. При приеме плацебо и комбинирован ной терапии валтрексом и вакциной подобных изменений не выявлено. Наиболее клинически значимой представля ется на фоне терапии динамика уровня цитокинов-регуляторов воспаления в соскобе слизистой оболочки цервикального канала. При проведении монотерапии валтрексом в 1-й группе и комбинированной терапии в 4-й и 5-й группах отмечено достоверное снижение локального уровня провоспалительного цитокина TНФ-a на 60, 25,6 и 53,1% соответственно. Однако только на фоне монотерапии валтрексом уровень TНФ-a снизился до контрольных значений, в то время как в 4-й и 5-й группах концентрация цитокина оставалась достоверно выше контроля (в 3,2 и 2,1 раза соответственно). При приеме плацебо (2-я группа) и проведении комбинированной терапии в 3-й группе уровень TНФ-a в цервикальном канале не изменялся и оставался высоким, достоверно превышая контрольные значения. Соотношение цитокинов Th1 и Th2 (ИФН-g/ИЛ-10) достоверно увеличилось на 20% в 1-й группе на фоне монотерапии валтрексом за счет увеличения процента ИФН-g-синтезирующих CD4+ лимфоцитов. При проведении комбиниро ванной терапии в 4-й группе отмечено достоверное снижение соотношения ИФН-g/ИЛ-10 на 46% за счет уменьшения процента ИФН-g-синтезирующих клеток и некоторого увеличения количества ИЛ-10-синтезирующих клеток. На фоне приема плацебо (2-я группа), комбиниро ванной терапии валтрексом и вакциной (3-я группа), валтрексом и препаратами и индукторами интерферона (5-я группа) соотношение цитокинов типов 1 и 2 не изменялось, но в последнем случае отмечено достоверное снижение на 41,4% числа ИФН-g-синтезирующих CD4+ лимфоцитов, что привело к незначительному преоблада нию Th2 цитокинов.
А — частота продромальных явлений до и на фоне терапии; Б — длительность ремиссии до и после окончания лечения. Так как уровень экспрессии маркеров активации (CD25, CD69, HLA-DR) позволяет оценить активность процессов пролиферации и дифференцировки клеток иммунной системы, мы проанализировали изменение данных показателей в ходе терапии в исследуемых группах. Достоверное уменьшение процента клеток, несущих маркеры активации, отмечено на фоне монотерапии валтрексом в 1-й группе (CD69+ на 26%, HLA-DR+ на 23,6%) и на фоне комбинированной терапии в 5-й группе (CD25+ на 46%, CD69+ на 46,1%, HLA-DR+ на 55,8%). Полученные в 1-й и 5-й группах данные могут свидетельствовать о снижении активности процессов пролиферации и дифференцировки в иммунной системе, а следовательно, о снижении интенсивности инфекционного процесса на фоне терапии. При проведении комбинированной терапии валтрексом и герпетической вакциной в 3-й группе процент клеток, несущих маркеры активации CD25+ и CD69+, достоверно увеличился на 43 и 69,8 соответственно по сравнению с показателя ми до лечения, что отражает процесс активации клеток иммунной системы в ответ на введение антигена при вакцинотерапии. Во 2-й и 4-й группах на фоне терапии достоверного изменения исследуемых показателей не отмечено. Заключение Таким образом, проведение больным с тяжелой формой ГГ адекватной, патогенетически обоснованной противогерпетической терапии приводит к повышению качества жизни и способствует восстановлению нарушенного баланса в системе иммунитета. В каждом конкретном случае выбор лечебного комплекса определяется клинической формой и тяжестью ГГ, наличием психоэмоциональных реакций на рецидивы инфекции, предшествующим лечением, его эффективностью и переносимостью, состоянием системы иммунитета и системы ИФН, наличием сопутствующих заболеваний. Методами выбора при лечении тяжелых форм ГГ у женщин являются терапия валтрексом в превентивном режиме и комбинированная терапия валтрексом и препаратами интерферона и его индукторами. В случае выраженных психоэмоцио нальных реакций на рецидивы ГГ методом выбора является длительное назначение аналогов нуклеозидов в превентивном режиме, которые оказывают наилучшее воздействие на качество жизни больного. При ГГ у женщин с аутоиммунными состояниями, при планировании беременности у женщин с тяжелым течением герпетической инфекции, при невынашивании беременности в анамнезе и выявлении в крови аутоиммунных маркеров (ВА, ХГЧ антител) целесообразно проведение комбинированной терапии с использовани ем иммуноглобулина. Применение цельновири онной убитой вакцины должно быть ограничено у женщин с фоновыми заболеваниями шейки матки и требует кольпоскопического контроля состояния шейки матки до и на фоне лечения. Литература 1. Марченко Л.А. Генитальная герпетическая инфекция у женщин (клиника, диагностика, лечение): Автореф. дис. …... д-ра мед. наук. М 1997. 2. Никонов А.П., Асцатурова О.Р. Генитальный герпес и беременность. Инфек и антимикроб тер 2000; 1: 3: 77—80. 3. Посевая Т.А., Цукерман В.Г., Шуваева Н.И. Роль герпетиче ской инфекции при эпителиальных дисплазиях шейки матки и опыт их лечения противогерпетическими препаратами. Вопр вирусол 1991; 6: 649. 4. Сидельникова В.М. Невынашивание беременности. М: Медицина 1986. 5. Сухих Г.Т., Ванько Л.В., Кулаков В.И. Иммунитет и генитальный герпес. Н. Новгород — М 1997. 6. Corey L. The medical importance of genital herpes simplex infection. Recommendations from the IHMF Management Strategies Workshop. France 1997. 7. Barton S.A. et al. Guide to the diagnosis and management of Genital Herpes. UK: Prs Wosby-Wolf 1998. 8. Herpesvirus Infections: New Paradigms for a New Millenium. In: Focus. Adis International. Australia 2000. 9. Reitano M., Tyring S., Lang W. Valaciclovir for the suppression of recurrent genital herpes infection: a large-scale dose range-finding study. J Inf Dis 1998; 178: 603—10. 10. Sahjose S., Munoz N., Boseh F. Sexually transmitted agents and cervical neoplasia. Int J Cancer 1994; 3: 358—363. 11. Whitley R.J., Weber T., Pass R. Herpesvirus infections in pregnancy. Recommendations from the IHMF Management Strategies Workshop. Spain 1999. 12. Wooley P. Genital herpes: treatment guidelines. Medscape Women's Health 1997; 2: 5. А.В. Шуршалина, Л.А. Марченко Научный центр акушерства, гинекологии и перинатологии РАМН, Москва |