Эффективность и безопасность применения оргалутрана (ганиреликса).
|
Оргалутран представляет собой раствор ганирелик са — синтетического декапептида, обладающего высокой активностью конкурентного антагониста по отношению к естественному гонадотропин-рилизинг гормону (ГнРГ).
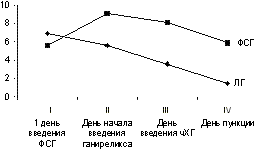
В программах вспомогательной репродукции ганиреликс применяется с целью предупреждения преждевременного выброса ЛГ. В крупных международных исследованиях показана высокая эффективность ганиреликса, его безопасность, а также ряд преимуществ перед применением агонистов ГнРГ [1—3]. Настоящее исследование проводилось в рамках III фазы клинических испытаний ганиреликса (предрегистрационные испытания в России). Целью исследования являлась оценка эффективности и безопасно сти применения оргалутрана (ганиреликса) у женщин, проходящих лечение бесплодия методами вспомогательной репродукции и подвергаемых контролируемой стимуляции суперовуляции. Материал и методы Исследование проводилось с ноября 2001 г. по февраль 2002 г. по протоколу №38642 в отделении экстракорпораль ного оплодотворения Клиники планирования семьи Московской медицинской академии им. И.М. Сеченова (ответственный исследователь Е.А. Калинина) и в лаборатории клинической эмбриологии НЦАГиП РАМН (ответственный исследователь Б.В. Леонов). Исследование было несравнитель ное, многоцентровое, проводилось по стандартам GCP. В исследовании участвовали 60 практически здоровых женщин (по 30 в каждом центре) из обычного контингента пациенток клиник ВРТ, страдающих бесплодием в браке и обратившихся для лечения методами вспомогательной репродукции: экстракорпорального оплодотворения (ЭКО) или интрацитоплазматической инъекции сперматозоида (ИКСИ) в яйцеклетку. В исследование включались пациентки в возрасте от 18 до 39 лет на момент начала контролируемой стимуляции суперовуляции , с индексом массы тела не менее 18 кг/м2 и не более 29 кг/м2 , массой тела не менее 50 кг, но и не более 90 кг, нормоменореей (регулярный менструальный цикл длительностью от 24 до 35 дней с индивидуальными колебания ми длительности плюс или минус 3 дня), подписавшие добровольное информированное согласие на участие в исследовании. Критерии для исключения из исследования были следующие: синдром поликистозных яичников, дисфункция яичников; наличие в анамнезе более трех циклов стимуляции суперовуляции (если была беременность, то после последней установленной беременности); отсутствие в анамнезе ответа со стороны фолликулярного аппарата яичников на введение гонадотропинов или слабый ответ; клинически значимое отклонение от нормы уровня гормонов (ФСГ, ЛГ, эстрадиол, общий тестостерон, тиреотропный гормон, пролактин) в крови, выявленное в раннюю фолликулярную фазу на 2—7-й день менструального цикла. Непосредственно перед первой инъекцией рекомбинант ного ФСГ (рФСГ) для исключения беременности определяли содержание b-субъединицы чХГ в сыворотке крови пациентки и проводили УЗИ полости матки. Также перед началом лечения проводилось полное клиническое и биохимическое исследование крови. Клинически значимые отклонения расценива лись как критерий исключения пациентки из исследования. Оргалутран («Органон», Нидерланды) применялся в виде раствора для подкожных инъекций в шприцах. В каждом шприце содержится 0,5 мл водного раствора, в состав которого входит 0,25 г ганиреликса. Для проведения контролируемой стимуляции суперовуляции применялся рекомбинантный фоллитропин b (пурегон, «Органон», Нидерланды). В качестве триггера овуляции использовался чХГ (прегнил, «Органон», Нидерланды). Пурегон назначался со 2—3-го дня менструального цикла по одной инъекции в день. Выбор фиксированной суточной стартовой дозы рФСГ (150, 200 или 250 МЕ) основывается на возрасте пациентки, ответе со стороны яичников в предыдущих циклах контролируемой стимуляции суперовуляции, эндокринном статусе. Во время применения оргалутрана, т.е. с 6-го дня стимуляции суточная доза пурегона могла быть скорректирована в зависимости от ответа яичников. Начиная с 6-го дня лечения рФСГ вводили оргалутран подкожно, по одной инъекции в день в дозе 0,25 мг. В случае если на стимуляцию рФСГ отмечался выраженный ответ со стороны яичников, оргалутран начинали вводить с 5-го дня стимуляции суперовуляции, по усмотрению лечащего врача. Начало введения оргалутрана могло быть также отсрочено, если отмечался слабый ответ со стороны яичников (к 6-му дню не было фолликулов диаметром более 14 мм по данным ультразвукового мониторинга). Во время применения оргалутрана, т.е. условно с 6-го дня стимуляции, суточная доза рФСГ корректировалась в зависимости от индивидуального ответа яичников. Ультразвуковой мониторинг проводился не реже, чем раз в 2 дня начиная со дня назначения оргалутра на и до дня введения овуляторной дозы чХГ. Критерием назначения овуляторной дозы чХГ прегнила в дозе 10 000 МЕ считалось наличие в яичниках, по данным ультразвукового мониторинга, по крайней мере трех фолликулов диаметром более 17 мм. Спустя 30—36 ч после введения овуляторной дозы чХГ производилось извлечение ооцитов путем трансвагинальной пункции, их оплодотворение с использованием техники ИКСИ или без ИКСИ. Перенос эмбрионов в полость матки осуществлялся на 3—5-й день после оплодотворения. Поддержка лютеиновой фазы проводилась по схеме, принятой в клиниках (комбинированное применение чХГ и натуральных гестагенов). Кровь для гормонального исследования брали в 1-й день назначения рФСГ, а также в день первой инъекции оргалутрана, в день введения овуляторной дозы чХГ, в день пункции фолликулов и аспирации ооцитов, в день переноса эмбрионов в полость матки, через 1 нед после переноса эмбрионов и через 2 нед после переноса эмбрионов. Определяли уровень ФСГ, ЛГ, эстрадиола и прогестерона. Эффективность оценивалась числом полученных яйцеклеток и числом эмбрионов хорошего качества. Безопасность оценивали по частоте возникновения осложнений. Результаты исследования обработаны методами описательной статистики, данные представлены с указанием средней и стандартной ошибки средней, доли в % и стандартной ошибки доли. Результаты и обсуждение Обследование и лечение согласно протоколу прошли 60 пациенток, которым была произведена пункция и аспирации ооцитов. Перенос эмбрионов осуществлялся в 57 случаях. Средний возраст женщин составил 26,6±0,5 года. Индекс массы тела пациенток в среднем составил 18,7±0,4 кг/м2 . В структуре бесплодия обследованной группы пациенток трубно-перитонеальное бесплодие наблюдалось у 71,35±5,9%, мужской фактор — у 30,45±6,1%, эндометриоз — у 5±2,8%, бесплодие неясного генеза — у 13,3±4,3%. Бесплодие было первичным у 36,7±6,2% женщин, вторичным — у 63,3±6,2%. Длительность бесплодия варьировала от 1 года до 19 лет, в среднем составляла 6,9±0,8 лет. Таким образом, представлен ный контингент женщин оказался типичной популяцией пациенток программ ВРТ. Стимуляция овуляции начиналась со 2-го или 3-го дня менструального цикла. Стартовая доза рФСГ варьировала от 150 до 250 МЕ (в среднем 170,3±10,8 МЕ) ежедневно. Длительность стимуляции суперовуляции (число дней введения рФСГ) колебалась от 8 до 15 дней (в среднем 8,36±0,3 дня). Оргалутран в 55 случаях применялся с 6-го дня стимуляции, в 3 случаях — с 7-го дня стимуляции и в 2 случаях — с 8-го дня. При этом длительность применения оргалутрана варьировала от 4 до 9 дней (в среднем 4,7±0,3 дня). Общая средняя доза рФСГ, полученного одной пациенткой за цикл стимуляции, составила 1646±154,6 МЕ. Эти данные показывают, что в схемах с оргалутраном требуются относительно невысокие стартовые дозы рФСГ, что связано с существующей неподавленной эндогенной продукцией ФСГ. Кроме того, длительность стимуляции 8,36 дня следует признать как относительно короткую, что подтверждает данные международных исследований [1—3] об уменьшении длительности введения ФСГ на 1—2 дня. Общая доза ФСГ 1646 МЕ является невысокой и также свидетельствует в пользу данных о меньшем расходе гонадотропинов в схемах с антагонистами ГнРГ. В результате стимуляции суперовуляции у 59 пациенток наблюдалось созревание 3 и более фолликулов диаметром более 17 мм по данным УЗИ. Число преовуляторных фолликулов варьировало от 3 до 16, в среднем наблюдалось 6,8±0,5 фолликула. У 1 пациентки преовуляторного состояния достиг лишь 1 фолликул. На момент назначения овуляторной дозы чХГ (10 000 МЕ) ни в одном случае не наблюдалось ультразвуковых признаков преждевременной лютеиниза ции или овуляции. Таким образом, по данным ультразвукового мониторинга фолликулогенез при применении рФСГ на фоне ганиреликса можно признать удовлетворительным. Концентрация ЛГ в крови в 1-й день стимуляции суперовуляции составляла в среднем 6,9±0,4 МЕ/л, в день начала применения оргалутрана наблюдался средний уровень ЛГ в крови — 5,63±0,61 МЕ/л, в день введения чХГ концентрация ЛГ составила 3,6±0,38 МЕ/л. Эти данные свидетельствуют о подавлении оргалутраном выработки ЛГ гипофизом, что обеспечивает защиту от преждевременной лютеинизации фолликулов. В то же время отмечается неглубокое подавление продукции эндогенного ЛГ на фоне введения ганиреликса, которое позволяет осуществлять стероидогенез на достаточном уровне при применении чистого ФСГ. Дальнейшее снижение уровня ЛГ (до 1,45 МЕ/л в день переноса эмбрионов) происходило за счет введения чХГ (см. рисунок). Ооциты были получены у всех пациенток. Стандартная процедура ЭКО проводилась в 71,7±5,8% случаев, ИКСИ в 28,3±5,8% случаев. Оплодотворение было успешным в 57 случаях из 60. В группе, где оплодотворение проводилось без ИКСИ, количество полученных и инкубируемых яйцеклеток в среднем составило 6,5±0,66. В группе, где оплодотворение проводилось с ИКСИ, среднее количество оплодотворяе мых зрелых яйцеклеток составило 6,3±0,48. Стадия двух пронуклеусов, свидетельствующая об успешности оплодотворения, наблюдалась в среднем у 4,4±0,5 яйцеклеток. Качество эмбрионов оценивалось по степени фрагментации. Получено в среднем 3,38±0,51 эмбриона I степени качества, 2±0,32 эмбриона II степени, 0,07±0,01 эмбриона III степени. Доля эмбрионов хорошего качества (I степень) составила 65,5±6,2%, доля эмбрионов удовлетворительного качества (II степень) составила 36,2±6,3% и III степени — 1,7±1,7%. Таким образом, в исследуемом протоколе была получена высокая частота оплодотворяемости ооцитов, высокая доля эмбрионов хорошего качества. В среднем осуществлялся перенос 2,72±0,6 эмбрионов. Переносились эмбрионы только хорошего и удовлетворительного качества. Беременность, подтвержден ная измерением в крови уровня ХГ (биохимическая беременность) через 2 нед после переноса эмбрионов, была зарегистрирована в 36,7±6,2% случаев в расчете на одну попытку лечения и в 38,6±6,4% случаев в расчете на перенос эмбрионов. Беременность ультразвуковыми методами исследования (по наличию плодного яйца в полости матки с визуализацией сердцебиения) была диагностирована у 17 пациенток. Таким образом, частота клинической беременности составила 28,3±5,8% в расчете на попытку и 29,8±6% в расчете на перенос. Многоплодная беременность наступила у 3 пациенток (одна тройня и две двойни). Таким образом, частота успешной имплантации составила 36,8±6,4% в расчете на перенос эмбрионов. Внематочных беременностей не наблюдалось.
Примечание. Представлены средние значения с указанием стандартной ошибки средней или стандартной ошибки доли. Средняя концентрация эстрадиола в день пункции фолликулов и аспирации ооцитов составила 2606±313 пмоль/л, что свидетельствует о невысоком риске развития синдрома гиперстимуляции яичников при исследуемом режиме лечения и в то же время о достаточном стероидогенезе для созревания эндометрия. В исследуемой группе не отмечалось случаев развития синдрома гиперстимуляции яичников тяжелой и средней степени тяжести.
Средние значения концентрации ЛГ и ФСГ в крови в день начала стимуляции. При проведении стимуляции суперовуляции и в период наблюдения, несмотря на прицельное внимание исследователей, не отмечалось появления местных или иных нежелательных явлений в ответ на введение оргалутрана. Заключение Получение достаточного количества ооцитов, отсутствие признаков преждевременной лютеинизации фолликулов, снижение уровня ЛГ на фоне применения оргалутрана, высокая доля эмбрионов высокого качества и высокая частота имплантации и наступления беременности свидетельствуют об эффективно сти антагониста гонадотропин-рилизинг гормона оргалутрана (ганиреликса) в предупреждении преждевременного выброса ЛГ при стимуляции суперовуля ции. Препарат в настоящем исследовании не вызывал нежелательных явлений, что свидетельствует о безопасности его применения. Благодарности Исследователи и компания «Органон» выражают благодарность за помощь в проведении исследования и объективном сборе данных сотрудникам контролирую щей исследовательской организации Валид Трио, Е. Гапченко и Е. Колесниковой Литература 1. The European Orgalutran study group, Borm G., Mannaerts B. Treatment with the gonadotropin-releasing hormone antagonist ganirelix in women undergoing controlled ovarian hyperstimulation with recombinant follicle stimulating hormone is effective, safe and convenient: results of a controlled, randomized, multicentre trial. Hum Reprod 2000; 15: 1490—1498. 2. The North American Ganirelix Study Group, Fluker M., Grifo J., Leader A. et al. Efficacy and safety of ganirelix acetate versus leuprolide acetate in women undergoing controlled ovarian hyperstimulation. Fertil Steril 2001; 75: 38—45. 3. The European and Middle East Orgalutran Study Group. Comparable clinical outcome using the GnRH antagonist ganirelix or a long protocol of the GnRH agonist triptorelin for the prevention of premature LH surges in women undergoing ovarian stimulation. Hum Reprod 2001; 16: 644—651. Б.В. Леонов2, Е.А. Калинина1, С.М. Белобородов2, И.Г. Торганова1, Е.А. Осина2, Е.Я. Финогенова2, Г.Д. Попов1, Л.Б. Киндарова2, К.А. Яворовская2, Д.В. Широкова1, J. Oberye3, E. Hooren3 1Московская медицинская академия им. И.М.Сеченова, Москва; 2Научный центр акушерства гинекологии и перинатологии РАМН, Москва; 3"Органон", Осс, Нидерланды |