Избирательный перенос одного эмбриона: за и против.
|
Одним из осложнений лечения бесплодия ЭКО является многоплодная беременность [1]. Чтобы избежать многоплодных беременностей многие европейские центры ЭКО приняли политику переноса не более двух эмбрионов [2]. Однако частота рождения близнецов все еще остается высокой [3], что ведет к увеличению в 4—5 раз затрат здравоохранения при выхаживании новорожденных [4]. Кроме того, многоплод ная беременность приводит к повышенной материнской смертности, преждевременным родам, более низкой массе новорожденных, а также к увеличению числа случаев пороков развития.
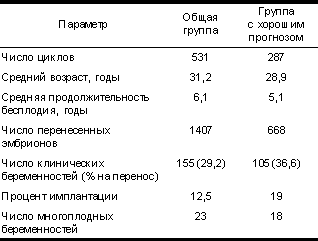
С совершенствованием технологий ЭКО за последние три года число многоплодных беременностей в нашем центре возросло с 10,6 до 21,8%, несмотря на тактику переноса не более трех эмбрионов. Одним из способов снизить число многоплодных беременностей без снижения общего процента беременности является избирательный перенос одного эмбриона с высоким потенциалом имплантации в сочетании с совершенствованием программы криоконсервации эмбрионов [5]. Цель работы — выявить группу пациенток с высоким риском многоплодной беременности и определить критерии отбора эмбрионов для переноса с высоким потенциалом имплантации. Материал и методы В исследование была включена 531 супружеская пара, прошедшая лечение методом ЭКО в МК ИДК с января 1999 г. по июнь 2001 г. Стимуляция суперовуляции проводилась по стандартному длинному протоколу с использованием а-ГнРГ (декапептил 0,1, «Ферринг») и чМГ (меногон, «Ферринг»). Ооциты и эмбрионы культивировали в среде IVF (MediCult, Дания). Обработку спермы проводили методом swim-up с использованием среды Sperm preparation (MediCult, Дания). Ооциты оплодотворяли через 4—5 ч после пункции, добавляя 50—100 тыс. подвижных сперматозоидов на ооцит. Через 18—20 ч после оплодотворения ооциты исследовали на наличие пронуклеусов. Дальнейшую оценку дробления и качества эмбрионов проводили через 46—48 ч после оплодотворения на инвертированном микроскопе при увеличении Ѕ400. Эмбрионы классифицировались согласно числу бластомеров, равномерности и сферичности бластомеров и наличию фрагментации. Перенос проводили на 3—4-й день культивирования. Для переноса отбирали не более 3 эмбрионов с наиболее высокой оценкой качества. Клинические беременности диагностировали через 3—4 нед после переноса при ультразвуковом исследовании по наличию плодного яйца в полости матки. Результаты и обсуждение Большинство врачей, работающих в лабораториях ЭКО, отклоняют идею переноса одного эмбриона, поскольку это снижает общий процент успешных циклов лечения. Однако врачи, занимающиеся методами ВРТ, нередко у молодых пациенток после переноса двух эмбрионов хорошего качества при первой попытке ЭКО получали беременность двойней. Мы предлагаем разработать тактику переноса числа эмбрионов с учетом риска многоплодной беременности [6—10]. Проведен анализ результатов циклов ЭКО за последние 3 года. Из 531 цикла ЭКО отобрана группа пациенток (287) с хорошим прогнозом по следующим критериям: возраст < 34 лет, не более одной попытки ЭКО ранее, наличие более 4 эмбрионов, доступных для переноса. Характеристика групп и результаты циклов представлены в табл. 1. Мы полагаем, что если бы пациенткам с хорошим прогнозом был перенесен один эмбрион, то учитывая процент имплантации (19), возможно было бы получено 55 клинических беременностей. При этом было бы перенесено 287 эмбрионов и дополнительно заморожен 381 эмбрион для возможного переноса в последующем цикле. Учитывая даже, что выживаемость эмбрионов после размораживания составит 50%, а процент имплантации при переносе размороженных эмбрионов, по крайней мере, 5%, перенос размороженных эмбрионов позволил бы получить еще дополнительно 10 клинических беременностей в группе с хорошим прогнозом. Таким образом, в данной группе, в общем, было бы получено 65 клинических беременностей и все они были бы одноплодные. Таблица 1. Характеристика групп пациенток и результаты лечебных циклов ЭКО
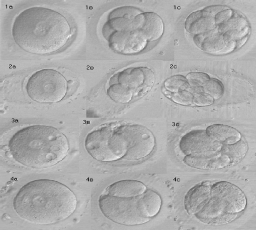
Для компенсации оставшихся 40 беременностей необходимо было бы провести дополнительно 210 циклов. Но все эти дополнительные беременности также были бы одноплодными. В результате из всех 155 клинических беременно стей общей группы было бы получено только 5 многоплодных беременностей вместо 23 и количество многоплодных беременностей снизилось от 15 до 3%. При этом наблюдалось бы снижение процента клинических беременностей с 29,2 до 19%. Чтобы избежать снижения числа успешных циклов, необходимо выработать критерии для отбора эмбрионов с высоким процентом имплантации. С этой целью нами была использована компьютерная программа, позволяющая фиксировать видеоизображение эмбрионов и создавать банк данных видеоизображений. В последнее время в ряде публикаций показана корреляция между морфологией пронуклеусов и потенциалом имплантации эмбрионов [11]. Поэтому изображения эмбрионов фиксировали при оценке оплодотворения на стадии пронуклеусов, на 2-й день культивирования при оценке дробления и на момент переноса (2, 3-й день). На рисунке представлена динамика развития эмбрионов в зависимости от морфологии в 1-й день культивирования.
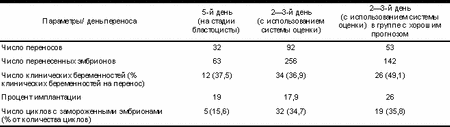
1а, в, с — идеальное развитие эмбриона; 2а, в, с — эмбрион с аномалией зоны пеллюцида; 3а, в, с — наличие вакуолей; 4а, в, с — неравные размеры пронуклеусов. В попытке установить критерии селекции лучших эмбрионов были проанализированы видеоизображения 46 эмбрионов с известной 100% имплантацией в циклах, закончившихся клинической беременностью. Система оценки качества эмбрионов в динамике развития учитывала морфологию пронуклеусов, наличие аномалий цитоплазмы и зоны пеллюцида (ZP), а также число бластомеров и наличие фрагментации на 2-й и 3-й дни культивирования. Оценка эмбрионов на стадии пронуклеусов производилась по следующим параметрам: — наличие двух пронуклеусов и двух полярных тел; — равномерность размеров пронуклеусов; — наличие нуклеолей в пронуклеусах; — форма эмбриона; — аномалии (ZP) (утолщения, выпячивания); Таблица 2. Зависимость исходов циклов ЭКО от дня переноса и оценки качества эмбрионов
— наличие вакуолей в цитоплазме эмбриона. Для переноса отбирали не более 2 эмбрионов с наивысшей оценкой. Используя анализ видеоизображений и данную систему оценки качества эмбрионов, были приняты следующие критерии отбора эмбрионов с высоким потенциалом имплантации: — наличие двух пронуклеусов равного размера через 16—20 ч после оплодотворения; — наличие в каждом пронуклеусе более 3 нуклеолей, выровненных для слияния; — отсутствие аномалий цитоплазмы и ZP; — отсутствие вакуолей; — 4—6 бластомеров равных размеров на 2-й день культивирования и 8—10 бластомеров на 3-й день культивирования; — отсутствие мультинуклеированных бластомеров; — менее 10% фрагментации. Чтобы проверить эффективность данной системы оценки проведен сравнительный анализ результатов циклов ЭКО после введения данной системы с циклами, в которых эмбрионы оценивались только по числу бластомеров и наличию фрагментации и культивированием эмбрионов до стадии бластоцисты. Результаты исследования представлены в табл. 2. Видно, что культивирование до стадии бластоцисты и перенос эмбрионов на 2-й день культивирова ния с оценкой эмбрионов в динамике развития (от стадии пронуклеусов до момента переноса) дают примерно одинаковые результаты по проценту клинических беременностей (37,5 и 36,9 соответственно) и проценту имплантации (19 и 17,9%). Однако число циклов, в которых было проведено замораживание эмбрионов, оказалось значительно ниже при культивировании до стадии бластоцисты (15,6% против 34,7%). Несмотря на совершенствова ние методик культивирования, in vivo невозможно создать идеальные условия для развития эмбрионов. Поэтому какая-то часть эмбрионов при продленном культивировании не достигнет стадии бластоцисты, хотя при отборе на более раннем этапе культивирова ния они могли бы быть заморожены и могли бы дать шанс на наступление беременности при переносе в последующих циклах. Перенос на 2—3-й день культивирования подразумевает короткое время культивирования, уменьшение стоимости процедуры и снижение риска отсутствия бластоцист на день переноса. Выводы 1. Избирательный перенос эмбрионов у женщин с хорошим прогнозом позволит существенно снизить частоту многоплодных беременностей с 15 до 3%. 2. Использование банка видеоизображений и системы оценки качества в динамике развития эмбриона позволит производить отбор эмбрионов с высоким потенциалом имплантации на более ранней стадии. 3. Перенос на 2—3-й день культивирования с использованием хорошей системы оценки качества эмбрионов дает возможность получить схожие результаты по проценту клинических беременностей с результатами культивирования до стадии бластоцисты. 4. Перенос эмбрионов на 2—3-й день культивиро вания позволяет получить большую кумулятивную частоту наступления беременности благодаря использованию программы криоконсервации эмбрионов. Таким образом, мы считаем, что избирательный перенос одного эмбриона в сочетании с хорошей системой оценки качества эмбрионов и совершенствова нием методов криоконсервации эмбрионов может быть эффективным в группе пациенток с высоким риском многоплодной беременности без риска снижения общего количества успешных исходов ЭКО. Литература 1. Bergh T., Ericson A., Hillensjц T. et al. Deliveries and children born after in-vitro fertilisation in Sweden 1982—95: a retrospective cohort study. Lancet 1999; 354: 1579—1585. 2. Coetsier T., Dhont M. Avoiding multiple pregnancies in in vivo fertilization: who's afraid of single embryo transfer? Hum Reprod 1998; 13: 2663—2664. 3. Templeton A., Morris J. Reducing the risk of multiple births by transfer of two embryos after in vivo fertilization. N Engl J Med 1998; 339: 573—577. 4. Gissler M., Malin Silverio M., Hemminki E. in vivo fertilization pregnancies and perinatal health in Finland 1991—1993. Hum Reprod 1995; 10: 1856—1861. 5. Tiitinen A., Halttunen M., Hдrkki P., Vuoristo P., Hyden-Granskog C. Elective single embryo transfer: the value of cryopreservation. Hum Reprod 2001; 16: 1140—1144. 6. Hu Y., Maxson W.S., Hoffman D.I. et al. Maximising pregnancy rates and limiting higher-order multiple conceptions by determining the optimal number of embryos to transfer based on quality. Fertil Steril 1998; 69: 650—657. 7. Martin P.M., Welch H.G. Probabilities for singleton and multiple pregnancies after in vivo fertilisation. Fertil Steril 1998; 70: 478—481. 8. Roseboom T., Vermeiden J., Schoute E. et al. The probability of pregnancy after embryo transfer is affected by the age of the patients, cause of infertility, number of embryos transferred, and the average morphology score, as revealed by multiple logistic regression analysis. Hum Reprod 1995; 10: 3035—3041. 9. Vilska S., Tiitinen A., Hyden-Granskog C. et al. Elective transfer of one embryo results in acceptable pregnancy rate and eliminates the risk of multiple births. Hum Reprod 1998; Suppl. 13: 148. 10. Wheeler C.A., Cole B.F., Frishman G.N. et al. Predicting probabilities of pregnancy and multiple gestation from in vivo fertilization — a new model. Obstet Gynecol 1998; 91: 696—700. 11. Gerris J., De Neuborg D., Mangelschots K. et al. Prevention of twin pregnancy after in vivo fertilization or intracytoplasmic sperm injection based on strict embryo criteria: a prospective randomized clinical trial. Hum Reprod 1999; 14: 2581—2587. 12. Azem F., Yaron Y., Amit A. et al. How many embryos to transfer in patients undergoing IVF? Hum Reprod 1996; 11: 229—230. О.Н. Пашкова, А.В. Панков, В.А. Пекарев Медицинская компания ИДК, Самара |