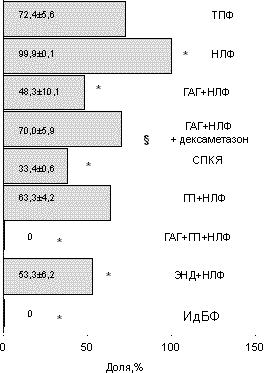
Вероятность наступления имплантации у женщин с разными формами бесплодия при лечении методом ЭКО.
|
Разработка методов оплодотворения in vivo дала уникальную возможность прижизненного наблюдения за гаметами и доимплантационными эмбрионами человека [1]. Благодаря этому были получены дополнительные данные о причинах нарушения репродуктив ной функции женщин при некоторых формах женского бесплодия, что связано с нарушениями процессов стероидо- и фолликулогенеза, оплодотворения, раннего эмбриогенеза и имплантации [2—5].
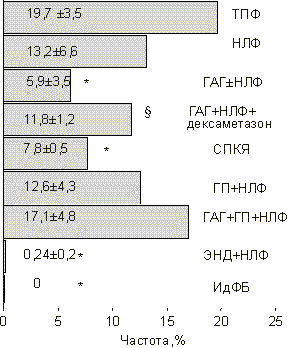
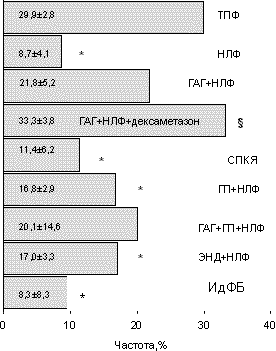
В настоящее время известно, что форма предшествующего бесплодия влияет на качество получаемых в ходе стимуляции суперовуляции ооцитов, их способность к оплодотворению [6], морфологические характеристики эмбрионов, характер их дробления и темпы развития [7, 8], наступление беременности, характер ее протекания и частоту возникновения осложнений [9, 10]. Не вызывает сомнения факт, что снижение частоты наступления имплантации при той или иной форме бесплодия наступает в результате одновременного воздействия целого комплекса как уже названных, так и до сих пор неизвестных причинно-следственных факторов. Формируя и поддерживая патологический процесс в репродуктивной системе женщины, они воздействуют на развитие ооцитов и эмбрионов и/или секреторную трансформацию эндометрия — главные составляющие процесса имплантации [11]. Способность к имплантации является одной из основных интегральных характеристик оценки качества эмбрионов в программе ЭКО [12]. Показано, что наибольшая частота наступления имплантации и беременности наблюдается при переносе эмбрионов с ранним наступлением первого деления и быстрыми темпами дробления; имеющих более 7 бластомеров одинаковой формы и равного размера и наличием не более 15% цитоплазматических фрагментов на 3-й день наблюдения [13, 14]. Одним из важнейших критериев отбора эмбрионов для последующего переноса в полость матки является их способность к формированию бластоцисты [15]. Перенос эмбриона в стадии бластоцисты позволяет увеличить частоту наступления беременности до 50—60% случаев на эмбриоперенос [16]. В литературе встречаются лишь отдельные работы, посвященные сравнительной оценке частоты наступления имплантации при разных формах женского бесплодия [3, 5]. Цель настоящего исследования — сравнительный анализ частоты наступления имплантации у женщин с разными формами бесплодия после лечения методом ЭКО и оценка исходов лечебных циклов, в которых наступила имплантация. Критерии оценки: частота наступления беременности, рождение живого ребенка и потеря беременности в ранние сроки [17]. Дополнительно анализировали критические сроки прерывания беременности при той или иной форме женского бесплодия. Материал и методы Проведен ретроспективный анализ частоты наступления имплантации и беременности в 282 лечебных циклах у женщин, проходивших лечение бесплодия в Красноярском центре репродуктивной медицины в 1999—2001 гг. Возраст женщин варьировал от 20 до 44 лет и в среднем составил 32,7±1,5 года. Длительность предшествующего бесплодия — 5—18 лет, в среднем — 7,6±1,5 года. Причиной бесплодия у абсолютного большинства пациенток явился трубно-перитонеальный фактор (ТПФ) один или в сочетании с эндокринопа тиями и наружным генитальным эндометриозом. При проведении клинико-лабораторного обследования полноценный двухфазный менструальный цикл выявлен у 110 пациенток, из них 106 — с изолированным ТПФ составили контрольную группу. У 4 пациенток диагностирована идиопатическая форма бесплодия (ИдФБ). Недостаточность лютеиновой фазы (НЛФ) менструального цикла, по данным функциональной, ультразвуковой диагностики и определения уровня прогестерона, во вторую фазу менструального цикла диагностирована у 161 женщины. Из них функциональ ная гиперпролактинемия (ГП+НЛФ) без нарушения функции щитовидной железы выявлена у 57 пациенток, смешанная гиперандрогения (ГАГ+НЛФ) — у 30, сочетание гиперандрогении и гиперпролактинемии (ГАГ+ГП+НЛФ) — у 5. Наружный генитальный эндометриоз, в основном I—III степени тяжести в сочетании с НЛФ (ЭНД+НЛФ) диагностирован у 36 больных. Отдельную группу составили 11 женщин с синдромом поликистозных яичников (СПКЯ) и хронической ановуляцией. Для анализа отобраны лечебные циклы пар, у которых при двукратном исследовании эякулята полового партнера подтверждена нормоспермия. Стимуляцию суперовуляции во всех лечебных циклах осуществляли с использованием препаратов а-ГнРГ (декапептил-дейли) в сочетании с чМГ (хумегон, меногон). В качестве индуктора овуляции использовали прегнил (10 000 МЕ). Начиная с 21-го дня менструального цикла, предшествующего стимуляции, с целью коррекции гормонального статуса и улучшения результатов лечения 15 пациенткам из группы ГАГ+ НЛФ назначали дексаметазон в дозе 0,5 мг 1 раз в сутки, до дня ультразвуковой диагностики беременности. Культивирование ооцитов и эмбрионов проводили по стандартной методике с использованием сред и реактивов производства фирмы "Medi-Cult" (Дания). Через 72 ч после пункции в матку переносили 2—4 эмбриона. Культивирование эмбрионов, оставшихся после выполненного переноса, продолжали еще 48—72 ч до формирования бластоцист. После этого рассчитывали отношение эмбрионов, сформировавших бластоцисты, к общему числу полученных в данной группе эмбрионов и выражали в процентах. В литературе данный показатель расценивается как косвенный критерий, характеризующий вероятность наступления имплантации [15, 16]. Частоту наступления имплантации в группе рассчитывали как отношение состоявшихся имплантаций к общему числу выполненных переносов эмбрионов и выражали в процентах. Долю имплантировавшихся эмбрионов рассчитывали как отношение количества выявленных при ультразвуковой диагностике на 28-й день после переноса эмбрионов плодных яиц к общему числу перенесенных эмбрионов и выражали в процентах. Помимо показателей, прямо или косвенно характеризующих вероятность наступления имплантации, нами проанализированы основные параметры, характеризующие исходы лечебных циклов, в которых наступила имплантация: частота наступления беременности, количество рождений живых детей, частота потерь беременности в ранних сроках. При расчете последних двух параметров исключали циклы, в которых была проведена медицинская редукция эмбрионов. Для определения критических сроков прерывания беременности при разных формах женского бесплодия изучено распределение по срокам гестации 35 самопроизвольных прерываний из 104 беременностей, полученных в 282 лечебных циклах. Статистический анализ полученных результатов, выраженных в виде M±m, проводили используя прикладную компьютерную программу "Biostat". С целью определения достоверности различий сопоставляемых величин применяли критерии Стьюдента и Z, методы корреляционного анализа. Результаты Результаты сравнительного анализа частоты формирования бластоцист при разных формах женского бесплодия приведены на рис. 1. Достоверное снижение образования бластоцист (p<0,05) по сравнению с контрольной группой женщин (ТПФ) отмечено в группах пациенток с ГАГ и НЛФ, СПКЯ, эндометриозом и ИдФБ. Применение патогенетической терапии дексаметазоном в группе женщин со смешанной ГАГ привело к достоверному увеличению количества бластоцист (p<0,05). В связи с тем, что изученный нами показатель созревания бластоцист в культуре зачастую используют в качестве прогностического в отношении наступления беременности [15], мы провели корреляционный анализ указанного критерия с частотой наступления беременности для всех изученных форм бесплодия. Выявлена слабая степень положительной связи (r = 0,23) между этими показателями. Далее нами изучались частота наступления имплантации после переноса эмбрионов и способность перенесенных эмбрионов к имплантации. Полученные данные представлены на рис. 2 и 3. Достоверно низкая частота наступления имплантации по сравнению с контрольной группой (p<0,05) отмечена у больных с эндометриозом, ГП, СПКЯ, изолированной НЛФ и ИдФБ (см. рис. 2).
Здесь и на рис. 2—6: * — р <0,05 — достоверность отличий по сравнению с контрольной группой; § — р <0,05 — достоверность отличий между группами ГАГ+НЛФ и ГАГ+НЛФ+ дексаметазон.
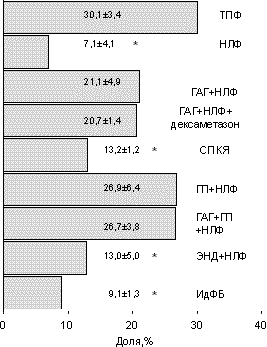
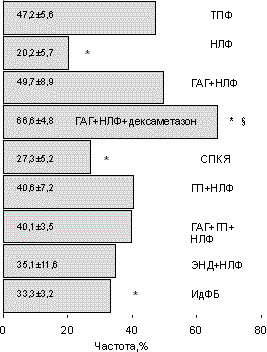
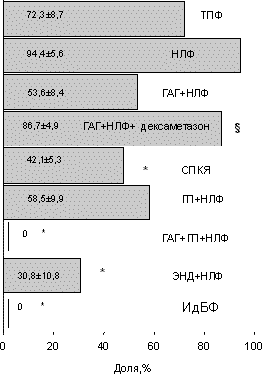
Обращает на себя внимание факт, что в группе ГАГ+НЛФ при сравнительно низком качестве эмбрионов (см. рис. 1) наступление имплантации было сравнимо с таковым в контроле (p>0,05). Обратная ситуация отмечена в группе с изолированной НЛФ. Количество имплантаций на перенесенный эмбрион, сравнимое с контролем (p>0,05), наблюдалось в группах женщин с ГАГ (кроме СПКЯ) и ГП. Дексаметазон достоверно увеличивал частоту наступления имплантаций в группе ГАГ+НЛФ, не влияя на долю имплантировавшихся эмбрионов в общем пуле перенесенных (см. рис. 2 и 3). Частота наступления беременности в зависимости от формы бесплодия приведена на рис. 4. Представленная зависимость практически повторяет таковую на рис. 2, что объясняется наличием сильной степени положительной связи между частотой наступления имплантации и беременности (r=0,92; p<0,001). Согласно нашим данным (рис. 5), срочными родами закончилось 48—53% беременностей у женщин со смешанной ГАГ и эндометриозом соответственно и 33% беременностей у женщин с СПКЯ (p<0,05). Дексаметазон достоверно увеличивал количество выношенных беременностей в группе ГАГ+НЛФ (p<0,05). У женщин с ИдФБ и сочетанием ГАГ+ГП+НЛФ произошло самопроизвольное прерывание беременно сти. Однако очень малое количество наблюдений в данных группах не позволяет делать каких-либо заключений на этот счет. При сравнительном анализе влияния формы бесплодия на так называемый показатель "take home baby" (рис. 6) выявлено его достоверное снижение по сравнению с контролем (p<0,05) в группах женщин с СПКЯ и эндометриозом. Нами было изучено распределение по неделям гестации 35 самопроизвольных прерываний из 104 беременностей, полученных в 282 лечебных циклах (см. таблицу). Как следует из таблицы, ранние репродуктивные потери в I триместре беременности составили 37,2% (13 из 35 беременностей). Все 13 беременностей прервались в 5—8 нед гестации. Обращает на себя внимание, что у женщин с эндометриозом в первые 3—5 нед закончилось ранним выкидышем 50% беременностей, что достоверно отличалось от показателей контрольной группы (p<0,05). Во II триместре беременности репродуктивные потери составили 42,8% (15 из 35 беременностей). Наибольшая частота самопроизвольных абортов в сроках 20—24 нед отмечена для групп ГАГ+НЛФ и СПКЯ. Недонашивание беременности отмечено в 20% всех случаев и с одинаковой частотой встречается в контрольной группе и группе женщин с ГП+НЛФ. Обсуждение
Распределение частоты прерывания беременности (в %) по срокам гестации у женщин с разными формами предшествующего бесплодия
Примечание. За 100% принято количество прервавшихся беременностей (n) в каждой нозологической группе. Приведены данные только по случаям мертворождений. Согласно современным представлениям, имплантация эмбриона в полости матки — сложный, многоступенчатый процесс, регуляция которого осуществляется при помощи большого количества гуморальных факторов и разнообразных межмолекулярных и межклеточных взаимодействий [18]. Эмбрион принимает в процессе имплантации активное участие путем выработки эффекторных соединений, взаимодействую щих с сигнальными молекулами эндометрия и иммунокомпетентными клетками матери [19]. Очевидно, что наибольшими имплантационными возможностями обладают наиболее качественные эмбрионы. Перенос эмбрионов в стадии бластоцисты позволяет реально увеличить частоту наступления имплантации и беременности в лечебных циклах ВРТ [15]. В связи с этим существует практическая потребность в разработке комплекса объективных критериев для отбора эмбрионов высокого качества. Проблема становится тем более очевидной, что в настоящее время появилась тенденция к переносу в полость матки одного эмбриона в стадии бластоцисты [13], что позволяет избежать ряда осложнений, характерных для лечения методами ВРТ. В нашем исследовании проведен сравнительный анализ имплантационного потенциала эмбрионов, полученных в лечебных циклах ЭКО у женщин с разными формами бесплодия. Длительно существующее женское бесплодие не может не сказаться на созревании ооцитов и последующем эмбриональном развитии. Полученные нами данные свидетельствуют о том, что форма предшествующего бесплодия оказывает непосредственное влияние на характер и темпы дробления эмбрионов человека. В нашей работе образование бластоцист было наибольшим у женщин с двухфазным менструальным циклом и наименьшим при эндометриозе, ГАГ и ИдФБ. Эти результаты хорошо согласуются с данными, полученными О.А. Воробьевой и соавт. [8], показавших, что эмбрионы от женщин из групп эндометриоз + НЛФ и ановуляция + поликистоз наиболее часто подвергались выраженной фрагментации бластомеров и реже всего достигали стадии 8 бластомеров на 3-й день культивирования. Отмечено, что при эндометриозе повышается частота остановки развития эмбрионов на ранних стадиях дробления. Ряд авторов называют изменение локального микроокружения ооцитов при эндометриозе возможной причиной низкого качества эмбрионов. Ооциты развиваются в условиях измененного стероидогенеза, при многократном превышении концентрации стероидов во внутренней среде фолликула [2, 20]. Резкое повышение содержания прогестерона вызывает освобождение цитокинов (интерлейкинов 1 и 6), что нарушает развитие ооцитов и снижает их способность к оплодотворению и делению [7]. Кроме того, в локальном микрооокружении ооцита найдена резко повышенная концентрация b-тромбоцитарного фактора роста и снижение продукции сосудисто-эндотелиаль ного ростового фактора, а следовательно, в развивающемся фолликуле нарушен ангиогенез [7, 21]. Указанные факторы приводят к снижению качества получаемых эмбрионов у женщин с эндометрио зом, что подтверждается данными нашего исследова ния. Так, несмотря на получение сравнимой с контролем частоты наступления беременности, доля бе ременностей, закончившихся срочными родами, и частота рождения живых детей были достоверно ниже, чем в контроле. Примечательно, что 50% всех прерываний беременностей произошло в срок 4—5 нед (p<0,05), что, как правило, характерно для генетических причин самопроизвольного аборта [22]. Наихудшие показатели практически по всем изучаемым критериям наблюдались при идиопатическом бесплодии. Беременность была получена только у 1 из 4 женщин, лечившихся в нашем центре. Согласно данным литературы, идиопатическое бесплодие наиболее резистентно к лечению [23]. Возможным объяснением этому могут послужить данные работы М. Bergere и соавт., в которой формирование идиопатического бесплодия связывают с наличием генетического блока деления ооцитов, что приводит к получению пула незрелых ооцитов, с крайне малым потенциалом к оплодотворению и дальнейшему развитию [6]. Нами получены данные, что для ГАГ характерно нарушение созревания эмбрионов до стадии бластоцисты. Ранее было показано, что у больных с ановуляцией повышается доля эмбрионов с выраженной фрагментацией и имеет место остановка в развитии на ранних стадиях эмбриогенеза [8]. Низкое качество ооцитов при СПКЯ связывают с наличием во внутренней среде фолликула высокой концентрации тестостерона [4], соединения, ингибирующего развитие мюллерова протока [25], или с получением большого пула яйцеклеток [26]. Показано, что чем большее количество фолликулов получено, тем худшее качество они имеют [27—29]. Плохое качество получаемых при СПКЯ ооцитов и эмбрионов уравновешивается их большим, по сравнению с контролем, количеством [25]. В нашей работе в группе женщин со смешанной ГАГ было получено 15,2±2,6 ооцитов, в группе женщин с СПКЯ — 14,2±1,9 ооцитов, что достоверно отличалось от показателей контрольной группы (9,1±0,9; р<0,05). Вместе с тем частота наступления имплантации и беременности достоверно различалась в группах женщин со смешанной ГАГ и СПКЯ (р<0,05). Объяснение этому, вероятно, стоит искать не в качестве полученных эмбрионов, а в нарушении секреторной трансформации эндометрия у этих женщин. При анализе сроков прерывания беременности при этих видах патологии выявлено, что для обоих форм имеется тенденция к повышению частоты самопроиз вольных абортов в сроках 20—24 нед гестации. Считается, что в этом периоде гестации начинается продукция стероидов корой надпочечников плода [30]. Выброс андрогенов плода увеличивает общий андрогенный пул матери, что может усугублять проявление истмико-цервикальной недостаточности (ИЦН). Кроме того, для ГАГ, включая СПКЯ, характерна более частая встречаемость многоплодных беременностей [31], что также осложняется развитием ИЦН. Нами не отмечено снижения частоты формирова ния бластоцист в группах женщин с ГП+НЛФ и изолированной НЛФ по сравнению с контролем. В этих же группах были максимальны доля беременностей, закончившихся срочными родами, и доля рожденных живыми детей. Возможно, высокая частота наступления имплантации и беременности при ГП может быть связана с состоянием эндометрия при данной патологии. Для ГП характерно повышение количества рецепторов эстрогенов [32], играющих решающую роль в подготовке эндометрия к наступлению имплантации [33, 34]. Эстрогены одновременно с пролифера цией клеток эндометрия стимулируют развитие секреторного аппарата клетки и синтез рецепторов к эстрогенам и прогестерону [35, 36]. Стоит отметить, что в группе НЛФ при достоверно низких, по сравнению с контролем (p<0,05), изученных показателях (частота наступления имплантации, доля имплантировавшихся эмбрионов и частота наступления беременности) адекватно проведенная коррекция второй фазы фертильного цикла и первых 6—8 нед гестации привела к вынашиванию всех полученных беременностей. Нами отмечено, что способность эмбрионов созревать до бластоцисты в культуре слабо коррелирует с последующей имплантацией и наступлением беременности. Возможным объяснением этого является факт, что образование бластоцист не исключает наличия хромосомных аномалий у таких эмбрионов [37]. Применение терапии дексаметазоном в группе ГАГ+ НЛФ достоверно (p<0,05) улучшало показатели раннего эмбриогенеза, частоту наступления имплантации и беременности, долю беременностей, закончившихся срочными родами, и количество рожденных живыми детей. Улучшение исходов лечебных циклов ранее было отмечено при применении преднизолона [38]. Подобный опыт воздействия на качество эмбрионов и их способность к имплантации открывает воз можности повышения результативности существую щих методов лечения бесплодия, в том числе методов ВРТ. Выводы 1. Способность эмбрионов человека развиваться до стадии бластоцисты в культуре связано с формой предшествующего женского бесплодия. Наименьшим потенциалом к формированию бластоцист обладали эмбрионы, полученные у женщин с ГАГ, эндометрио зом и ИдФБ. Формирование бластоцист слабо коррелировало с последующей имплантацией и наступлением беременности. 2. В группах женщин с СПКЯ, НЛФ и ИдФБ отмечалась наиболее низкая частота наступления имплантации и беременности. 3. Доля беременностей, закончившихся родами, и доля рожденных живыми детей были наименьшими в группах женщин с ГАГ, эндометриозом и ИдФБ. 4. Применение терапии дексаметазоном в группе ГАГ+НЛФ достоверно улучшало показатели раннего эмбриогенеза, частоту наступления имплантации и беременности, повышало долю беременностей, закончившихся срочными родами, и количество рожденных живыми детей. 5. Общим критическим сроком для всех полученных беременностей явились 6—8 нед гестации. Критический срок прерывания беременности при эндометриозе — 4—5 нед гестации, при ГАГ — 20—24 нед гестации, что совпадает с критическим сроком по развитию ИЦН. Литература 1. Воробьева О.А. Особенности оплодотворения ооцитов и доимплантационного развития эмбрионов человека в зависимости от показателей гаметогенеза: Автореф. дис. ...… д-ра биол. наук. Ст-Петербург 2001; 34. 2. Harlow C.R., Cahill D.J., Maile L.A., Talbot W.M. et al. Reduced preovulatory granulosa cell steroidogenesis in women with endometriosis. J Clin Endocrinol Metab 1996; 81: 1: 426—429. 3. Roseboom T.J., Vermeiden J.P., Schoute E., Lens J.W. et al. The probability of pregnancy after embryo transfer is affected by the age of the patient, cause of infertility, number of embryo transferred and the average morphology score as revealed by multiple logistic regression analysis. Hum Reprod 1995; 10: 11: 3035—3041. 4. Teissier M.P., Chable H., Paulhac S., Aubard Y. Comparison of follicle steroidogenesis from normal and polycystic ovaries in women undergoing IVF: relationship between steroid concentrations, follicle size, oocyte quality and fecundability. Hum Reprod 2000; 15: 12: 2471—2477. 5. Arici A., Oral E., Bukulmez O., Duleba A. et al. The effect of endometriosis on implantation: results from the Yale University in vivo fertilization and embryo transfer program. Fertil Steril 1996; 65: 603—607. 6. Bergere М., Lombroso R., Gombault M., Wainer R. et al. An idiopatic infertility with oocytes metaphase I maturation block. Hum Reprod 2001; 16: 10: 2136—2138. 7. Garrido N., Navarro J., Remohi J., Simon C. et al. Follicular hormonal environment and embryo quality in women with endometriosis. Hum Reprod Update 2000; 6: 1: 67—74. 8. Воробьева О.А., Кирсанов А.А., Потин В.В. Особенности оплодотворения ооцитов и развития эмбрионов в культуре у женщин с недостаточностью яичников. Пробл репрод 1999; 4: 17—21. 9. Витязева И.И. Течение, ведение и исход беременностей после лечения бесплодия методами вспомогательной репродукции: Автореф. дис. …... канд. мед. наук. М 1999; 20. 10. Орлова О.О. Течение беременности, родов и послеродо вого периода у женщин после медикаментозной коррекции гормональной недостаточности яичников: Автореф. дис. ...… канд. мед. наук. Ст-Петербург 1996; 23. 11. Garrido N., Navarro J., Garcia-Velasco J., Remohi J. et al. The endometrium versus embryonic quality in endometriosis-related infertility. Hum Reprod Update 2001; 8: 1: 95—103. 12. Royen E.V., Mangelschots K., Neubourg D.D, Laureys I. et al. Calculating the implantation potential of day 3 embryos in women younger than 38 years of age: a new model. Hum Reprod 2001; 16: 2: 326—332. 13. Royen E.V., Mangelschots K., Neubourg D.D., Valkenburg M. et al. Characterization of a top quality embryo, a step towards single-embryo transfer. Hum Reprod 1999; 14: 9: 2345—2349. 14. Alicani M., Calderon G., Tomkin G., Garrisi J. et al. Cleavage anomalies in early human embryos and survival after prolonged culture in vivo. Hum Reprod 2000; 15: 12: 2634—2643. 15. Fisch J.D., Rodriguez H., Ross R., Overby G. et al. The graduated embryo score (GES) predicts blastocyst formation and pregnancy rate from cleavage — stage embryos. Hum Reprod 2001; 16: 9: 1970—1975. 16. Lundin K., Bergh C., Hardarson T. Early embryo cleavage is a strong indicator of embryo quality in human IVF. Hum Reprod 2001; 16: 12: 2652—2657. 17. Camus E., Poncelet C., Goffinet F., Wainer B. et al. Pregnancy rates after in vivo fertilization in cases of tubal infertility with and without hydrosalpinx: a meta-analysis of published comparative studies. Hum Reprod 1999; 14: 5: 1243—1249. 18. Klentzeris L.D.The role of endometrium in implantation. Hum Reprod 1997; 12: 170—175. 19. Гьюдайс Л.С. Имплантирующаяся оплодотворенная яйцеклетка и материнский организм. Пробл эндокринол 1999; 5: 30—32. 20. Koninckx P.R., Kennedy S.H., Barlow D.H. Endometriotic disease: the role of peritoneal fluid. Hum Reprod Update 1998; 4: 5: 741—751. 21. Carlberg M., Nejaty J., Froysa B., Guan Y. et al. Elevated expression of tumour necrosis factor-alpha in cultured granulosa cells from women with endometriosis. Hum Reprod 2000; 15: 6: 1250 — 1255. 22. Bui T.-H., Wramsby H. Micromanipulative assisted fertilizations till clinical research. Hum Reprod 1996; 11: 5: 921—924. 23. Здановский В.М., Витязева И.И. Течение, ведение и исход беременности после лечения бесплодия методами вспомогательной репродукции (собственные результаты). В кн.: Экстракорпоральное оплодотворение и его новые направления в лечении женского и мужского бесплодия. Под ред. В.И. Кулакова, Б.В. Леонова. М: МИА 2000; 598—611. 24. Dor J., Shulman A., Levran D., Ben-Rafael Z. et al. The treatment of patients with polycystic ovarian syndrome by in vivo fertilization and embryo transfer: a comparison of results with those of patients with tubal infertility. Hum Reprod 1990; 5: 7: 816—818. 25. Fallat M.E., Siow Y., Mara M., Cook C. et al. Mullerian-inhibiting substance in follicular fluid and serum: a comparison of patients with tubal factor infertility, polycystic ovary syndrome, and endometriosis. Fertil Steril 1997; 67: 5: 962—965. 26. MacDougall M.G., Tan S.L., Balen A., Jacobs H.S. A controlled study comparing patients with and without polycystic ovaries undergoing in vivo fertilization. Hum Reprod 1993; 15: 8: 233—237. 27. Feldberg D., Ashkenazi J., Dicker D. et al. Ovarian cyst formation: a complication of gonadotropin-releasing hormone agonist therapy. Fertil Steril 1989; 51: 1: 42—45. 28. Воробьева О.А., Потин В.В., Корсак В.С., Кирсанов А.А. и др. Особенности оплодотворения ооцитов и развития эмбрионов в культуре в зависимости от реакции яичников на стимуляцию суперовуляции. Пробл репрод 1998; 5 : 53—58. 29. Plachot M., Crozet N. Fertilization abnormalities in human in vivo fertilization. Hum Reprod 1992; 7: 1: 89—94. 30. Актуальные проблемы невынашивания беременности. Цикл клинических лекций. Под ред. В.М.Сидельниковой. М: НЦАГиП РАМН 1999; 22. 31. Micola M., Hiilesmaa V., Halttunen M., Suhonen L. et al. Obstetric outcome in women with polycystic ovarian syndrome. Hum Reprod 2001; 16: 2: 226—229. 32. Феськов А.М. Гистологические особенности эндометрия у женщин с эндокринным бесплодием. Укр мед журнал 2000; 5: 120—123. 33. Гузов И.И. Введение в медицину репродукции. Зачатие у человека. Стероидные гормоны и другие медиаторы имплантации. Введение в рецепторологию. http: //www. center reproduction. ru 34. Pierro E., Minici F., Alesiani O. et al. Stromal-epithelial interactions modulate estrogen responsiveness in normal human endometrium. Biol Reprod 2001; 64: 831—838. 35. Побединский Н.М., Балтуцкая О.И., Омельяненко А.И. Стероидные рецепторы нормального эндометрия. Акуш и гин 2000; 3: 5—8. 36. Lecce G., Meduri G., Ancelin M. et al. Presence of estrogen receptor b in the human endometrium through the cycle: expression in glandular, stromal, and vascular cells. J Clin Endocrinol Metab 2001; 86: 1379—1386. 37. Sandalinas M., Sadowy S., Alicani M., Calderon G. et al. Developmental ability of chromosomally abnormal human embryos to develop to the blastocyst stage. Hum Reprod 2001; 16: 9: 1954—1958. 38. Кечиян К.Н. Факторы, влияющие на эффективность лечения бесплодия методом экстракорпорального оплодотво рения: Автореф. дис. ...… канд. мед. наук. М 1992; 20. В больнице звонит телефон: А.В. Светлаков, М.В. Яманова, А.Б. Салмина, О.А. Серебренникова Красноярская государственная медицинская академия, Центр репродуктивной медицины, Красноярск — Вы не будете так любезны посмотреть, есть ли кто-нибудь в шестой палате? — Нет, там никого нет. — Ага! Значит мне все-таки удалось сбежать!
|