Эмбриональные стволовые клетки.
|
Терминологический словарь
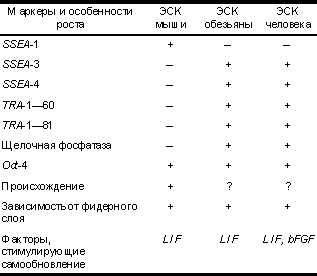
Тотипотентность — способность клетки дифференцироваться в любой вид ткани зародыша, включая экстраэмбриональ ные, и дать начало целому организму. Плюрипотентность — способность клетки дифференцировать ся во множество тканей взрослого организма, включая герменальную линию. Мультипотентность — способность клетки дифференциро ваться в несколько видов тканей взрослого организма. Аллофенные мыши — химерные мыши, развивающиеся в результате объединения двух эмбрионов на преимплантацион ной стадии или после инъецирования плюрипотентных клеток в бластоцисту от другой мыши. Постепенное повышение уровня жизни в современном постиндустриальном обществе и научные открытия в области медицины привели к изменению соотношения наиболее распространенных заболеваний. С начала XX века значительно уменьшилась доля бактериальных и вирусных инфекций и возрос вклад наследственных болезней и недугов с генетической предрасположенностью в общую картину заболеваемости. По данным ВОЗ, сегодня в США (как стране с высокоразвитой системой здравоохранения) заболевания сердечно-сосудистой системы находятся на первом месте в качестве причины смерти, на втором — различные виды рака, на третьем — болезнь Альцгейме ра. Такая ситуация не является случайностью, к ней привел процесс увеличения средней продолжитель ности жизни и постепенное старение человеческого общества в странах с относительно высоким уровнем жизни. Решение проблемы лечения многих заболеваний, распространение которых за последние два—три десятилетия приобрело мировые масштабы (инфаркт миокарда, болезнь Альцгеймера, болезнь Паркинсона, СПИД, сахарный диабет, дистрофия Дюшена и др.), предлагают новые методы клеточной терапии и генотерапии. Самым перспективным направлением клеточной терапии является использование различных типов стволовых клеток в качестве средства для замещающей терапии. Термин "стволовые клетки" (СК) подразумевает под собой некую популяцию ранних недифференцированных родоначальников "взрослых" клеток. Чтобы стать "взрослыми", они должны пройти процесс дифференцировки. Терминально дифференциро ванные клетки, как правило, не способны к дальнейшим митозам, и их количество восстанавливается за счет деления малодифференцированных предшествен ников. Необходимо отличать "взрослые" и фетальные тканеспецифичные стволовые клетки от эмбриональных стволовых клеток (ЭСК), которые получают из внутренней клеточной массы эмбрионов (бластоцист) на преимплантационной стадии. Тканеспецифичные "взрослые" стволовые клетки ответственны за регенерацию поврежденных тканей и поддержание тканевого гомеостаза, например, для физиологического обновления кожи и клеток крови. Тканеспецифичные стволовые клетки присутствуют во многих тканях взрослого организма (в настоящее время учеными открыты популяции "взрослых" стволовых клеток в 20 различных органах и тканях), однако их трудно выявить из-за малочисленности популяции в ткани, их гетерогенности и технических сложностей в идентификации и прослеживании потомков. В настоящее время особое внимание уделяется изучению недавно открытых тканеспецифичных нервных, мышечных (сателлитных) стволовых клеток и стволовых клеток печени. Наиболее хорошо изученными "взрослыми" стволовыми клетками являются плюрипотент ные гемопоэтические стволовые клетки и стволовые клетки кожи, которые уже нашли широкое применение в медицинской практике. Природа не устает преподносить нам сюрпризы. Таким неожиданным сюрпризом явилось открытие в течение последних 3 лет пластичности стволовых клеток костного мозга (как гемопоэтических, так и стромальных), которые, как оказалось, могут после трансплантации мигрировать в соответствующие ткани и давать начало нервным клеткам, клеткам скелетной мускулатуры, кардиомиоцитам и клеткам печени. Выдвигается теория, что во взрослом организме тканеспецифичные стволовые клетки обладают взаимозаме щающим свойством и могут превращаться в определенных условиях в другие типы стволовых клеток. Например, итальянскими учеными в нейрональных стволовых клетках были открыты эндотелиальные и гемопоэтические рецепторы, которые, как предполагает ся, необходимы для ответа на внешние сигналы и могут быть ответственны за изменение судьбы клетки. Плюрипотентность ЭСК является установленным фактом в отличие от линий "взрослых" тканеспеци фичных стволовых клеток. ЭСК обладают гораздо большими потенциями в дифференцировке и огромным пролиферативным потенциалом, что делает их перспективным источником материала для клеточной терапии. Современные открытия в области переноса ядер в сочетании с клеточными технологиями ЭСК могут привести к решению вопроса об отторжении трансплантатов в организме реципиента. Историческая справка Внутренняя клеточная масса (ВКМ) бластоцисты (у мыши — 3,5 дня post coitum (р.с.), у человека — 5 дней p.c.) представляет собой пул плюрипотентных клеток, которые дают начало всем дифференциро ванным типам клеток, формирующим как сам эмбрион и впоследствии взрослый организм, так и ряд экстраэмбриональных тканей. У мыши к 4,5-му дню р.с. плюрипотентные клетки ВКМ, выстилающие бластоцеле, образуют примитивную энтодерму и экстраэмбриональную линию клеток, из которой развивается висцеральная и париетальная энтодерма. Начиная с 4,5-го по 6,5-й день р.с. остающиеся плюрипотентные клетки, объединенные под общим названием эпибласт, подвергаются пролиферации, избирательному апоптозу и мигрируют, формируя монослой цилиндрических эпителиальных плюрипотентных клеток — примитивной эктодермы. Примитивная эктодерма в процессе гаструляции преобразуется в мезодерму, эктодерму, энтодерму собственно эмбриона, дает начало герменальным клеткам и некоторым экстраэмбриональным тканям. Таким образом происходит нормальное развитие зародыша. Наряду с этим известна значительная пластичность раннего эмбриогенеза млекопитающих, за счет которой обеспечивается полноценное развитие эмбриона (в частности, мыши) даже после разрушения 85% его клеток до наступления стадии органогенеза. Эту особенность связывают со способностью плюрипотентных клеток репрограммировать свое развитие под воздействием внешних факторов. Интересно, что большая часть бластоцисты никогда не участвует в формировании взрослого организма. Согласно J. Gilbert (1988), собственно зародышу дает начало всего около трех клеток ВКМ, что было подтверждено экспериментальными данными по созданию аллофенных мышей (Mintz, 1970). Идея выделения плюрипотентной линии клеток, процессы дифференцировки которых напоминали бы таковые при раннем эмбриональном развитии млекопитающих, давно захватила умы ученых. Наличие такой линии облегчило бы изучение экспрессии генов, потенциала дифференцировки, механизмов взаимодей ствия клеток ранних зародышей без необходимости их культивирования и разрушения. Эта задача была отчасти реализована в 70-е годы XX века после начала активного изучения линий кле ток тератокарциномы. Тератокарциномы — опухоли половых желез, возникающие спонтанно в яичниках и семенниках или индуцированно (например, после экспериментальной имплантации бластоцисты не в матку, а под соединительнотканную капсулу почки). Клетки таких опухолей, называемых также эмбриональными карциномами (ЭК), являются стволовыми, могут экстенсивно пролиферировать и дифференци роваться в самые разнообразные ткани: кишечный и дыхательный эпителий, мышечную, нервную, жировую, хрящевую и костную ткани. Дифференцирован ные клетки больше не делятся и поэтому более не являются злокачественными. Впервые (Kleinsmith и Pierce, 1964) было показано, что из одной клетки ЭК, инъецированной интраперитонеально, может развиться тератокарцинома, содержащая ряд дифференциро ванных тканей. В 1975 г. (Martin и Evans) продемонст рировали способность клеток эмбриональной карциномы образовывать трехмерные структуры — эмбриоидные тела и дифференцироваться в условиях in vivo. Тератокарциномы происходят из половых клеток, однако по своим морфологическим и биохимическим свойствам их клетки напоминают бластомеры внутренней клеточной массы. В 1981 г. (Stewart и Mintz) была получена мышь, часть тканей которой происходила из инъецированных клеток ЭК в бластоцисту. И в настоящее время эксперимент такого рода (т.е. создание химеры) является основным доказательством относительной тотипотентности линии клеток. Примером идеальной тотипотентной клетки является оплодотворенная яйцеклетка — зигота, из которой развивается целый организм с его разнообра зием клеточных типов (около 200), включая экстраэмбриональные ткани. В большей или меньшей степени, но все остальные клетки обладают ограниченным потенциалом в дифференцировке. Считается, что в организме пулом тотипотентных клеток являются герменальные (или половые), однако механизмы, позволяющие реализовать их свойство тотипотентности, запускаются только после слияния женской и мужской гамет. Все остальные стволовые линии клеток эмбриона, плода или взрослого организма разделяются на плюрипотентные и мультипотентные, которые отличаются друг от друга своим потенциалом дифференцироваться соответственно в широкий или узкий спектр "взрослых" клеток. Потенциал дифференцировки, заложенный в плюрипотентных клетках, более широкий. Клетки плюрипотентной линии должны обладать способностью дифференцироваться в герменальные. Доказать их вклад в формирование тканей половых желез можно с помощью создания химер. В последнее время наиболее популярным методом создания химер является инъекционный, когда в бластоцисту млекопитающего инъецируют 8—10 плюрипотентных ЭСК, они агрегируются с ВКМ бластоцисты и участвуют в построении тканей зародыша наряду с ее собственными. Результатом такого эксперимента будет химерное животное, имеющее более чем двух генетических родителей. Обычно линии лабораторных животных (мышей) подбираются таким образом, чтобы химер можно было легко выявить визуально по окраске шерсти. Химеры имеют окраску в виде полос разного цве Эмбриональные стволовые клеткита, так как клетки кожи у них двух типов. Соответст вующим образом, если клетки плюрипотентной линии вносят вклад в формирование гонад химер, они должны обладать гаметами двух типов: ведущими свое происхождение от "хозяйской" бластоцисты и от инъецированных плюрипотентных клеток. Изучение клеток ЭК открыло перед учеными перспективы использования плюрипотентных культур клеток, однако злокачественность, наличие многочисленных хромосомных аберраций, анеуплоидия ( в частности — отсутствие во всех линиях Y-хромосомы) и зачастую ограниченный характер способности к дифференцировке не позволил использовать клетки ЭК в качестве идеального объекта для генетических исследований и потенциального источника тканевых трансплантатов. Первым и единственным видом млекопитающих, у которого достоверно удалось получить стабильную линию ЭСК, явилась лабораторная мышь. Биология размножения, ранние стадии эмбриогенеза мыши в 70-х годах XX века были уже хорошо изучены, высокая интенсивность размножения этого вида позволяла получать эмбрионы в практически неограниченных количествах. Наличие плюрипотентных клеток в эмбрионах, по крайней мере на преимплантационных стадиях, было доказано (Gardner и Papaioannou, 1975) методом получения химер, а способность формировать тератокарциномы после инъекции в перитонеаль ную полость иммунодефицитным мышам — еще раньше (Stevens, 1970). После нескольких безуспешных попыток непосредственного выделения линии ЭСК из мышиных эмбрионов (Cole и соавт., 1965; Sherman, 1975) и временного поддержания культуры ЭСК-подобных клеток в условиях in vivo (Solter и соавт., 1975; Atienza-Samols и соавт., 1978) Evans и Kaufman, наконец, удалось получить в 1981 г. около 15 линий мышиных ЭСК с нормальным кариотипом и доказать их плюрипотентность методом создания инъекцион ных химер. Эмбриональная стволовая клетка: что это такое? Рассматривая особенности ЭСК, эмбриональных герменальных клеток и клеток ЭК, можно сделать вывод о наличии ряда общих черт, которыми, по-видимому, обладают все эмбриональные плюрипотентные клетки. Вместе с тем у линий таких клеток могут иметься свои свойства в том случае, если они были получены от разных видов животных, из разных тканей или из эмбрионов на разных стадиях развития. Своего рода эталоном культуры ЭСК служат мышиные ЭСК, с которыми подлежат сравнению все прочие находящие ся в стадии разработки линии. Итак, ЭСК должны быть получены из плюрипотентной клеточной популяции, быть стабильно диплоидными и сохранять нормальный кариотип в условиях in vivo, обладать способностью к неограничен ному делению и при этом оставаться в примитивном эмбриональном состоянии. Линии ЭСК должны спонтанно дифференцироваться в многочисленные типы клеток — производные всех трех зародышевых листков (эктодермы, энтодермы и мезодермы). Процесс дифференцировки должен происходить как в условиях in vivo, так и в тератомах, т. е. в опухолях, образующихся после инъецирования суспензии ЭСК подкожно или в перитонеальную полость иммунодефицит ных животных. ЭСК в случае ее инъецирования в "хозяйскую" бластоцисту и агрегации с реципиентным эмбрионом должна обладать свойством давать начало многочисленным производным, которые участвуют в образовании всех тканей организма, включая герменальную, и приводить к получению химер. Доказательством плюрипотентности каждой единичной клетки в культуре служит клонирование , т. е. посев с низкой плотностью и получение линии из единственной клетки, что исключает возможность совместного культивирования нескольких типов клеток с разными потенциями в дифференцировке. На настоящий момент только мышиные ЭСК удовлетворяют всем этим условиям. Согласно международной терминологии, плюрипотентными стволовыми клетками считаются стволовые клетки, происходящие из эмбриона, примордиальных герменальных клеток или тератокарциномы, которые способны к безграничному самообновлению (делению), дифференцировке в экстраэмбриональные ткани и производные трех зародышевых листков; за ЭСК принимаются клетки, полученные из эмбриона на преимплантационной стадии, соответствующие всем перечисленным выше условиям, эмбриональные герменаль ные клетки — клетки, выделенные из эмбриональных гонад (у мыши от 8,5—12,5-дневного, у человека от 5—11-недельного эмбриона) и также соответствующие всем перечисленным выше критериям. В настоящее время ЭСК вызывают наибольший интерес. Морфологически для них характерна правильная сферическая форма, они обладают крупным ядром и ясной цитоплазмой в виде узкого пояска, растут в виде объемных колоний, возвышающихся над поверхностью роста. Каждая колония может содержать всего от нескольких клеток до нескольких сотен. Данные об экспрессии маркеров и особенностях роста различных линий ЭСК приведены в табл. 1. Одним из ключевых свойств ЭСК является синтез теломеразы, рибонуклеопротеина, добавляющего концевые повторы к теломерам хромосом, тем самым поддерживая их длину на постоянном уровне. С этим ферментом связана бессмертность ЭСК. Большинство диплоидных соматических клеток не экспрессируют теломеразу и вступают в фазу "репликативного старения" после 50—80 удвоений популяции и, таким образом, имеют конечную протяженность пролифера тивной жизни в клеточной культуре. Вызывает немалый интерес, когда некоторые популяции нормальных соматических клеток in vivo также синтезируют теломеразу, например "взрослые" стволовые клетки (гемопоэтические стволовые клетки). Но в этом случае теломеразная активность не сохраняется при культивировании клеток in vivo. Напротив, клетки ранних эмбрионов проявляют высокую теломеразную активность. Сходным образом недавно полученные ЭСК человека сохраняют высокий уровень экспрессии теломеразы даже после более чем 300 раундов удвоения популяции и одного года в культуре. В целом основные свойства клеток раннего эмбриона, такие как нормальный кариотип и высокая теломеразная активность, поддерживаются в течение длительного периода в культуре. Эта уникальная черта ЭСК является базисом для изучения процессов клеточного старения и механизмов обновления стволовых клеток. Этапы получения линии ЭСК Получение мышиных ЭСК является хорошо отработанной технологией. За рубежом ряд институтов занимается выделением и поддержанием линий ЭСК мыши, которые поставляются в исследовательские лаборатории по всему миру. Наиболее высокого выхода ЭСК (30%) удается достичь при использовании эмбрионов мышей линии 129. Выделить ЭСК с подтвержденным свойством колонизирования герменальных тканей химерных зародышей удалось только у небольшого числа мышиных линий, отличных от линии 129. В качестве материала для выделения ЭСК из мышиных эмбрионов использовались диссоциированные морулы (Eistetter, 1989), интактные бластоцисты (Evans и Kaufman, 1981) и изолированная внутренняя клеточная масса (Martin, 1981). В 2000 г. австралийскому коллективу в университе те Monash удалось получить культуру подобных ЭСК из бластоцист мышей, выращенных из реконструиро ванных эмбрионов после переноса ядер кумулюсных клеток в энуклеированные ооциты. Данная линия клеток характеризовалась всеми свойствами, присущими ЭСК, включая экстенсивную дифференцировку в производные трех зародышевых листков in vivo и in vivo. Эту работу можно считать первым шагом на пути к созданию собственных ЭСК пациента методами терапевтического клонирования и к преодолению проблемы отторжения трансплантатов — конечного результата направленной дифференцировки культур ЭСК. Таблица 1. Экспрессия маркеров и ростовые характеристики ЭСК мыши и приматов
Примечание. SSEA-1, 3, 4 — поверхностные стадиеспецифич ные эмбриональные антигены, TRA-1—60, TRA-1—81 — поверхностные антигены, обнаруженные первоначально в клетках эмбриональной карциномы человека, Oct-4 — POU-транскрипционный фактор, регулирующий тотипотентность клеток эмбрионов млекопитающих. Исследования, связанные с получением и использованием ЭСК человека, вызывают много споров и дискуссий из-за источника материала, необходимого для разработки линий. Коллективами авторов из США и Австралии, впервые получивших ЭСК человека (Thomson и соавт., 1998; Reubinoff и соавт., 2000), были использованы "лишние" 5—6-дневные бластоцисты человека. Эмбрионы были получены в ходе работы лабораторий ЭКО и применялись в научных целях с предварительного согласия пациентов. Как известно, яйцеклетка млекопитающего окружена "блестящей оболочкой" (zona pellucida), выполняющей ряд важных функций. Значительно увеличившаяся после экспандирования бластоциста растягивает и свою оболочку. Когда сила натяжения превышает определенный предел, zona pellucida лопается и происходит вылупление эмбриона или процесс, известный под названием "hatching". На стадии 5 дней нормально развивающийся эмбрион состоит из хорошо выраженной внутренней клеточной массы и клеток трофобласта, выстилающих полость бластоцисты — бластоцел е. На преимплантационной стадии (на 5—6-й день) человеческий эмбрион состоит всего из 50—150 клеток, что характерно соответственно для ранней и поздней бластоцист. ВКМ такого зародыша включает не более чем 20—40 клеток. Задача исследователей состояла в том, чтобы выделить эти клетки и размножить. Методом ферментативной обработки у эмбрионов удалялась блестящая оболочка, на втором этапе методом иммунохирургии элиминировались клетки трофобласта. Каждая из ВКМ помещалась в среду DMEM на слой фидерных клеток. В течение 9—15 дней клетки ВКМ образовывали разрастания, по морфологии характерные для ЭСК, только колонии человеческих ЭСК были более уплощенные. Колонии диссоцииро вались и пересевались каждые 7 дней. В качестве фидера использовалась первичная культура эмбриональных мышиных фибробластов, которые рутинно применяются для культивирования мышиных ЭСК. Считается, что фидерный слой выделяет в среду еще полностью неидентифицированные ростовые факторы, которые способствуют митотической активности клеток и препятствуют их дифференцировке. Одним из таких факторов является фактор ингибирования лейкемии (leukemia inhibitory factor — LIF). В итоге, американскому коллективу из Висконсин ского университета во главе с J. Thomson удалось получить пять линий ЭСК человека с нормальным кариотипом, а именно: 3 линии ЭСК с кариотипом ХХ (Н1, Н13, Р14) и две линии — XY (Н7, Н9). Для работы потребовалось 36 человеческих эмбрионов, из которых после доращивания 20 развились до стадии бластоцисты. В результате отбора остались 14 бластоцист высокого качества, которые непосредственно использовались для выделения ВКМ. Согласно статье, опубликованной в журнале Nature Biotechnology (август, 2000), австралийская команда c B. Reubinoff и соавт. ненадолго отстала от своих американских коллег и выделила две линии ЭСК HES-1 и HES-2 всего из 4 бластоцист. Дальнейшее культивирование ЭСК человека осуществлялось аналогично поддержанию в культуре мышиных ЭСК. В качестве фидерного "питающего" слоя для поддержания ЭСК в недифференцирован ном состоянии использовались эмбриональные мышиные фибробласты. Культивирование человеческих ЭСК с другими клетками может таить в себе серьезную потенциальную опасность при использовании их в терапевтических целях, поскольку увеличивается риск иммунного отторжения трансплантатов (явление ксенотрансплантации) и переноса некоторых инфекционных заболеваний, поэтому ЭСК должны представлять собой чистую популяцию. Преодоление этого препятствия возможно различными способами, например, проводить культивирование ЭСК человека на специально обработанных поверхностях (ламинином или матригелем) или с применением кондициониро ванных сред (Carpenter и cоавт., 2001). Выделение ЭСК различных видов млекопитающих В течение двух последних десятилетий было сделано множество попыток выделения ЭСК ряда млекопитающих, включая человека. Полученные линии обладали рядом характерных для ЭСК свойств, однако доказать участие клеток этих линий в формировании герменальной линии зародыша после их инъецирова ния в "хозяйскую" бластоцисту и соответственно передачу их наследственных свойств последующим поколениям удалось исключительно у мыши. Клетки кролика, подобные ЭСК, были получены из бластоцист на 4—5-й день (Graves, Moreadith, 1993). Они проявляли положительную реакцию на щелочную фосфатазу, формировали эмбриоидные тела in vivo; методом инъецирования в бластоцисты удалось создать инъекционных химер с нормальной фертильностью, однако попытка доказать колонизирование герменальной линии химерных зародышей окончилась неудачей. Получение ЭСК крыс могло бы значительно облегчить создание трансгенных животных этого вида. Как вид лабораторных животных, крысы более предпочтительны для исследований в области нейробиологии из-за более близкого сходства (по сравнению с мышами) их нервной системы с человеческой. Хотя были получены клоны подобных ЭСК, обладающих активностью щелочной фосфатазы, экспрессирующих маркеры SSEA-1 и Oct-4, но получение с их помощью химер так и осталось нерешенной задачей. Поскольку свиньи представляют собой превосход ную модель для изучения различных заболеваний человека, в научной литературе было значительное количество публикаций, связанных с культивировани ем линий клеток, выделенных из ВКМ бластоцист. Одной из последних была статья Chen и соавт. (1999). Им, как и другим авторам, удалось выделить культуру подобных ЭСК, колонии которых напоминали мышиные, однако фенотип клеток имел сходство с эпителиальным. Клетки экстенсивно дифференцировались in vivo в производные энтодермы, мезодермы и эктодермы; методом инъецирования клеток в бластоцисты был даже получен химерный поросенок, что подтверждалось его пигментацией и анализом ДНК-маркеров, однако колонизирования герменальной линии клеток не происходило. У крупного рогатого скота получение ЭСК более доступно, поскольку возможно получение большого количества эмбрионов in vivo, однако наилучшим материалом являются бластоцисты, развившиеся in vivo. Для использования в качестве фидерного слоя были использованы различные типы клеток, включая гомологичные клетки гранулезы, фетальных фибробластов, мышиных фетальных фибробластов, клетки STO; однако ни один из типов не годился для стимуляции пролиферации эмбриональных клеток в недифференцированном состоянии в течение длительного периода. Cibelli и соавт. (1998) получили линию подобных ЭСК из ВКМ бластоцист крупного рогатого скота, которые пролиферировали в течение более чем 12 мес без дифференцировки и с характеристиками ЭСК (высокое ядерно-цитоплазматическое отношение, четко очерченные края колоний). Линия сходных с ЭСК клеток была получена с использованием метода переноса ядер для создания трансгенных телят, несущих ген-маркер В-галактозидазы. Авторам удалось получить 6 химерных телят. Хотя был показан химеризм в гонадах, однако наследование трансгена не было установлено. Приматы служат наиболее близкой моделью многих человеческих заболеваний, они могут помочь значительно увеличить наше понимание патогенеза таких специфических заболеваний человека, как болезни Альцгеймера или Паркинсона. ЭСК макак-резусов (1995), а позднее обычных мармозеток (1996) были получены тем же коллективом во главе с J.Thomson, выделивших в 1998 г. ЭСК человека. ЭСК приматов культивировались на монослое из мышиных эмбриональных фибробластов, экспрессировали эмбриональ ные поверхностные маркеры SSEA-3 и SSEA-4, дифференцировались во множество клеточных типов, формировали эмбриоидные тела и после инъецирова ния в иммунодефицитную мышь образовывали тератокарциномы. Были также предприняты попытки разработать линии ЭСК норки, сирийского хомячка, овец и коз, однако, несмотря на огромную исследовательскую активность в данной области, сегодня не выделено ЭСК с точно подтвержденным свойством колонизирования герменальной линии зародыша ни у одного вида животных, за исключением мыши и цыплят. Почему же получение ЭСК от других видов животных представляет собой такую сложную, возможно, невыполнимую задачу? Эмбриогенез у мыши может быть временно приостановлен на стадии бластоцисты. Этот феномен (диапауза) был приобретен некоторыми видами млекопитающих, чтобы выжить в неблагоприятных для воспроизводства условиях окружающей среды или при дефиците питательных веществ, связанном с кормлением мышат предыдущего помета. В таком случае эмбрионы развиваются до стадии вылупившейся бластоцисты и остаются неимплантированными в матке. У мышей состояние диапаузы может продолжаться несколько недель, в течение которых бластоцисты не теряют способности возобновить свое развитие. Таким образом, этот вид грызунов обладает эволюционно возникшим механизмом длительного сохранения в недифференцированном состоянии плюрипотентных клеток эпибласта, что оказалось решающим фактором для получения многих стабильных линий этих клеток. В нормальных условиях плюрипотентные свойства эпибласта в раннем эмбриогенезе у мышей сохраняются 4—5 дней. Потенциал длительного культивиро вания его клеток может быть реализован при культивировании эмбрионов в присутствии цитокина — фактора ингибирования лейкемии. В отсутствие последнего плюрипотентность ЭСК утрачивается, и они "уходят" в дифференцировку. Нужно отметить, что выделенные линии ЭСК различных видов животных не равноценны по своим свойствам. Они экспрессируют наборы различных поверхностных маркеров, обладают неодинаковыми потенциями в дифференцировке. Например, ЭСК приматов (и человека в том числе) могут в культуре давать начало "гигантским" клеткам трофобласта, которые синтезируют хорионический гонадотропин, тогда как ЭСК мыши не обладают этой способностью. Поэтому следует иметь в виду, что ЭСК разного происхожде ния могут быть не идентичны по своим базисным особенностям. Дифференцировка Способность дифференцироваться во многие, если не в абсолютно все, клетки взрослого организма объясняет огромный интерес, проявляемый к ЭСК в настоящее время. В условиях in vivo это свойство ЭСК начинает проявляться с образования эмбриоидных тел, которые представляют собой сферические конгломераты клеток, находящихся на начальных стадиях дифференци ровки. Структура эмбриоидных тел напоминает таковую эмбрионов млекопитающих на ранней постимплантационной стадии. Они образуются в случае культивирования клеток на малоадгезивной поверхности или в суспензии. Такие клеточные агрегаты формируют через 2—4 дня наружный слой из энтодермальных клеток, и в этом случае называются простыми эмбриоидными телами. Энтодермальные клетки образуют базальную мембрану, напоминающую мембрану Рейхарта, компоненты которой синтезируется в нормальном эмбриогенезе клетками париетальной энтодермы. В центре простых эмбриоидных тел остается популяция плюрипотентных эмбриональных стволовых клеток, которые продолжают делиться. Если культивирование в суспензии происходит более чем 2—4 дня, то простые эмбриоидные тела дифференцируются далее и формируют цистические эмбриоидные тела, которые содержат внутри полость, наполненную жидкостью; их внутренняя поверхность выстлана эктодермальными цилиндрическими клетками. Простые эмбриоидные тела могут быть перенесены на поверхость, покрытую желатиной. Вслед за этим они прикрепляются к субстрату, и начинается процесс миграции клеток. Если культура поддерживается в течение 10 дней или более, то образуется множество дифференцированных производных — предшествен ников "взрослых" клеток. Процесс дифференцировки в таком случае имеет хаотичный характер. ЭСК мыши дифференцируются in vivo в ряд эмбриональных и "взрослых" типов клеток — производных энтодермы, мезодермы и эктодермы: кардиомиоциты, гемопоэти ческие предшественники, клетки желточного мешка, клетки скелетной и гладкой мускулатуры, адипоциты, хондроциты, эндотелиальные клетки, меланоциты, нейроны, клетки глии, примитивной энтодермы и панкреатические клетки островков Лангерганса. Дифференцировка ЭСК in vivo проявляется в формирова нии доброкачественных опухолей — тератом. Возникают они после инъекции суспензии клеток интраперитонеально в иммунодефицитную мышь. Например, после введения человеческих ЭСК легко идентифицируются такие ткани в составе тератом, как поперечно исчерченные и гладкие мышцы, костная и хрящевая ткани, кожный и кишечный эпителий, волос, нервная ткань, включая глию и ганглии. Клетки в момент миграции из эмбриоидных тел, когда происходит "распластывание" последних на желатинизированной поверхности, чувствительны к воздействию различных индукторов дифференцировки . Одним из таких веществ-индукторов является ретиноевая кислота — производное витамина А. Она выполняет важные регуляторные функции во время эмбрионального развития, однако дает тератогенный эффект в случае приема во время беременности. Добавление ретиноевой кислоты к культуральной среде в разные сроки и в разной концентрации вызывает преимущественную дифференцировку в нервные клетки (выход нейронов до 100%, среди них допаминер гических до 16%), кардиальные, жировые, гладкие и поперечно исчерченные мышечные клетки. Существуют и другие индукторы, или факторы роста, сдвигающие дифференцировку в определенном направлении. Однако до сих пор не обнаружено соединений, специфично воздействующих на ЭСК и заставляющих все клетки одной популяции дифференцироваться в один тип ткани. Такие ростовые факторы, как активин-А и TGFb1, вызывают дифференци ровку преимущественно в производные мезодермы; ретиноевая кислота, EGF, BMP-4, bFGF — в производные мезодермы и эктодермы; NGF и HGF — в производные всех трех зародышевых листков. Поэтому главная цель современных исследований в области ЭСК — научиться не только получать популяции, обогащенные определенными типами функционально активных клеток, но и разработать эффективные методы по их отсортировыванию от клеток с другим типом дифференцировки и недифференцированных предшествен ников, которые несут потенциальную опасность образования опухолей в организме реципиента. Этого удается достигнуть различными способами. Дифференцировка в клетки поджелудочной железы Около 5—10% больных сахарным диабетом страдают I типом заболевания. Эта форма диабета возникает, главным образом, в результате аутоиммунного разрушения панкреатических b-клеток, с последующей инсулиновой недостаточностью и полной зависимостью от лечения экзогенным инсулином. Сегодня единственным кардинальным методом лечения диабета I типа является трансплантация островков Лангерганса поджелудочной железы, однако доступность этого метода ограничена в связи с недостатком донорского материала. Линии ЭСК человека могут стать новым неисчерпаемым источником для клеточной терапии таких больных. Это подтверждают исследова ния на мышиных ЭСК, проведенные в начале 2001 г. американскими учеными во главе с R. McKay (Национальный институт здоровья). Методом комбинации условий роста и факторов дифференцировки им удалось получить обогащенную культуру клеток, сходных с b-клетками поджелудочной железы и синтезирую щих инсулин; они образовывали кластеры, которые находились в тесной взаимосвязи с нейронами. Культура содержала свыше 15% инсулинсекретирующих клеток. При изучении глюкозозависимой индукции секреции инсулина оказалось, что содержание последнего после добавления глюкозы в клетках увеличива лось в 5 раз, а выделение в культуральную среду — в 40 раз! Однако каждая из них все равно содержала в 50 раз меньше инсулина, чем содержится в обычной b-клетке поджелудочной железы, т.е. клетки, полученные в ходе опыта, синтезировали меньше гормона, чем нормальные в островках Лангерганса. Дальнейшие исследования могут привести к получению популяций с более высоким уровнем синтеза инсулина. Была изучена способность выживать и секретировать инсулин в условиях in vivo — после подкожной трансплан тации кластеров клеток в мышь с индуцированным стрептозотоцином сахарным диабетом. На 12-й день происходила васкуляризация трансплантатов, морфологически они напоминали нормальные панкреати ческие островки b-клеток. Коррекции гипергликемии не происходило, однако у этих мышей поддержива лась постоянная масса, и они выживали дольше, чем контрольные животные. Израильтяне S. Assady и соавт. в августе 2001 г. доказали способность человеческих ЭСК давать начало инсулинсекретирующим клеткам в ходе спонтанной дифференцировки. Хотя в культуре на 14—19-й день было выявлено всего 1—3% клеток, секретирующих этот гормон, дальнейшие исследования по направлен ной дифференцировке должны привести к увеличению эффективности существующих протоколов. Ученым еще предстоит подтвердить функциональную активность дериватов ЭСК (глюкозозависимую индукцию секреции исулина) и безопасность их трансплан тации для пациента. Дифференцировка в кардиомиоциты Другим активно изучаемым направлением в области ЭСК является получение кардиомиоцитов. "Взрослые" кардиомиоциты выходят из клеточного цикла и поэтому не могут регенерировать. Таким образом, значительная их потеря невосполнима и ведет к развитию прогрессирующей сердечной недостаточ ности. Новым терапевтическим подходом к лечению инфарктов является увеличение функционально активных миоцитов в районе некроза методом имплантации миогенных клеток. Недавние исследования продемонстрировали, что фетальные кардиомиоциты могут выживать в области инфаркта, дифференцироваться и улучшать работу сердца (Soonpaa и соавт., 1994; Leot и соавт., 1996), однако из-за недостатка фетальных тканей этот метод едва ли сможет войти в широкую практику. И в этом случае ЭСК человека могут оказаться весьма кстати. В 1996 г. M. Klug и соавт. из Института кардиологии в Индианаполисе разработали оригинальный метод для получения популяций очищенных кардиомиоцитов из ЭСК мыши. Они получили генетически модифициро ванную культуру ЭСК мыши, несущих под промотором тяжелой цепи кардиального a-миозина — белка, синтезируемого в кардиомиоцитах, селективный агент — ген устойчивости к антибиотику неомицину (G-418). Поскольку в клетках сердечной поперечно исчерченной мускулатуры и их предшественниках экспресси руется ген, кодирующий белок миозин, то происходила также экспрессия гена резистентности к G-418, находящегося под тем же промотором. Ученые сочетали спонтанную дифференцировку ЭСК с отбором резистентных колоний клеток к неомицину. В результате они получили популяции клеток, на 99,6% состоящих из кардиомиоцитов. Для сравнения: в культурах, не подвергавшихся селекции, общее содержание сердечных клеток было 0,55%, а после механической изоляции — 3,4%. Перенос полученных кардиомиоцитов в стенку левого желудочка мыши закончился приживлением трансплантированной ткани, обладающей нормальной топографией и морфологией. С помощью молекулярных, цитологических, электрофизиологических методов и изучения сократительной способности было продемонстрировано, что кардиомиоциты, полученные из ЭСК, имеют физиологические и молекуляр ные особенности, характерные для нормальных клеток сердца. Частота успешного приживления дериватов ЭСК не отличалась от наблюдаемой при трансплантации фетальных кардиомиоцитов мыши. Содержащие миофибриллы донорские клетки располагались в виде рядов и образовывали плотные контакты с кардиомиоцитами реципиента, после трансплантации не наблюдалось формирования тератом. Изучению развития кардиомиоцитов человека на ранних этапах препятствует отсутствие подходящей модели in vivo. Поэтому существует информационный вакуум в области дифференцировки ранних предшественников кардиальных клеток, возникновения возбудимости, развития сочетания возбудимости-сокра тимости и молекулярных сигналов, обеспечивающих эти процессы. В августе 2001 г. в The Journal of Clinical Investigation появилась статья израильских авторов во главе с L. Gepstein о получении кардиомиоцитов из ЭСК человека. При спонтанной дифференцировке появление сокращающихся клеток происходило на 4—22-е сутки после переноса эмбриоидных тел на желатинизиро ванную поверхность. 8,1% эмбриоидных тел содержали cокращающиеся области. Энергичные сокращения наблюдались в культуре в течение 5 нед. Световая микроскопия показала, что сокращающиеся участки состояли в основном из относительно небольших мононуклеарных клеток с диаметром 10—30 мкм округлой или удлиненной формы.С помощью электронной микроскопии установлено наличие мононуклеарных клеток с параллельным расположением ассоциаций миофибрилл в некоторых клетках, ориентированных иррегулярно; в других же обнаружена более зрелая организация в виде саркомер с хорошо различимыми Z-линиями. Ученые подтвердили зависимость между стадией зрелости кардиомиоцитов и возрастом эмбриоидных тел. Полученные сердечные клетки экспресси ровали ряд кардиальных специфических генов и транскрипционных факторов. Таким образом, получение неограниченного количества человеческих кардиомиоцитов может явиться своего рода катализатором исследований в области раннего развития сердечной поперечнополосатой мускулатуры, ее функции, функциональной геномики, клеточной терапии и тканевой инженерии. В последнее время активно изучается вопрос о применении модели дифференцировки ЭСК человека в кардиомиоциты в фармакологическом и токсикологиче ском тестировании, определении тератогенного эффекта и влияния на репродуктивную функцию ксенобиотиков, лекарственных препаратов, промышленных отходов (Scholz и соавт., 1999; Rohwedel и соавт., 2001). Дифференцировка в нервные клетки Обширные исследования были проведены, чтобы изучить нейральную дифференцировку ЭСК. Получены различные линии ЭСК и разработаны протоколы для эффективной индукции дифференциров ки в нейрональные и глиальные клетки. Например, частота спонтанной дифференцировки ЭСК линии BLC6 в нейроны достигала 15—30%. После стимулирования низкой концентрацией ретиноевой кислоты (10-7 М) выход нейронов достигал 100% (Struebing и соавт., 1995). Установлено соответствие между стадией зрелости нейронов и синтезом в них нейронспецифических белков. Гены, кодирующие белки нейрофиламентов с низкой (NFL) и средней (NFM) молекулярной массой, белок синаптических пузырьков синаптофизин, потенциалзависимые ионные каналы (Ca2+, Na+, K+-каналы) экспрессировались на ранней стадии индуцированного нейрогенеза. Дальнейший процесс дифференцировки характеризовался увеличением плотности потенциалзависимых ионных каналов, а также генов и протеинов, свойственных зрелым нейронам. Решение проблемы обогащения культуры производными ЭСК, дифференцирующимися в определен ном направлении (например, нейрональном), и их эффективное выделение заключается в добавлении комбинаций специфических морфогенов или ростовых факторов, кокультивировании или котрансплан тировании ЭСК с тканями- или клетками-индуктора ми, имплантировании недифференцированных ЭСК в определенные органы или ткани животных (тканевое окружение вызывает индукцию направленной дифференцировки), создании ЭСК, гиперэкспрессирую щих гены, кодирующие тканеспецифичные транскрип ционные факторы, отборе клеток, уже вступивших на путь дифференцировки, и выделении их с помощью активируемых флюоресценцией сортерами (поточными цитометрами). Одними из первых применили метод поточной цитометрии для выявления флюоресценции дериватов ЭСК (нейронов и глии) сотрудники Института анатомии и физиологии Кельнского университета во главе с K. Addicks. Ими была получена трансфициро ванная методом электропорации культура ЭСК мыши. Генетическая конструкция представляла собой ген зеленого флюоресцирующего белка (Green Fluorescent Protein — GFP) медузы Aquorea victoria, находящийся под контролем регулирующей последовательности второго интрона гена нестина — белка, синтезируемого наиболее ранними предшественниками нервных клеток. Замысел ученых оправдался, все клетки, вступившие на путь нейрональной дифференцировки, при облучении их возбуждающим излучением с длиной волны 320 нм испускали зеленое свечение. Отселектиро ванные предшественники нервных клеток инъецировались в количестве 300 000 в мозг подопытных крыс. Через 7 дней в криосрезах была установлена локализация флюоресцирующих клеток как в месте инъекции, так и в окружающей ткани мозга. Клетки в срезах, экспрессирующие GFP, характеризовались нейроэпителиальной морфологией и иммунореактивно стью к нестину. Даже через 4 нед после транспланта ции кластеры нейральных предшественников, дифференцированных в зрелые нейроны, обнаруживались в области инъекции. Трансплантация генетически измененных клеток поднимает вопрос о Т-клеточном иммунном ответе, вызванном синтезом чужеродного белка. Однако, как показали исследования (Amhold и соавт, 2000), проблема отторжения может не приниматься во внимание, так как из-за гематоэнцефалического барьера мозг является иммунологически защищенным органом. В опыте немецких ученых не отмечено неконтролируемой пролиферации клеток и опухолевого роста в месте трансплантации. Для исключения возможности образования опухолей предлагается использовать "гены-самоубийцы"( в частности, ген тимидинкина зы вируса герпеса-1), убивающие клетку в случае ее малигнизации. Осенью 2001 г. израильский коллектив во главе с N. Benvenisty подтвердил ранее установленную B. Reubinoff и соавт. способность ЭСК человека давать начало зрелым нейронам, экспрессирующим легкую цепь нейрофиламента NF-L (белок, характерный как для незрелых, так и для зрелых нейронов), тяжелую цепь нейрофиламента NF-H (протеин зрелых нейронов), допаминовые рецепторы DRD-1 и серотониновые рецепторы 5HT2A и 5HT5A, а также ключевого фермента, участвующего в синтезе нейротрансмиттеров: допа-декарбоксилазы (DDC). Показано, что ретиноевая кислота и b-фактор роста нервов увеличивают количество нейрональных клеток, образующихся из ЭСК человека, с 21% в контроле до 52 и 39% соответственно. Нейроны образовывали в культуре сложные переплетения нейрональных отростков и формировали различной степени сложности "нейрональную сетку". Представленные результаты свидетельствуют о возможности получения неограниченного количества зрелых человеческих нейронов в культуре. Дифференцировка в гемопоэтические предшественники При изучении гемопоэза исследователи использовали ЭСК мыши, чтобы получить in vivo производные различных кроветворных ростков. Это достигалось либо методом образования эмбриоидных тел (Keller, 1995), либо сокультивированием со стромальными линиями клеток (Nakano и соавт., 1994) или выращиванием на покрытом коллагеном лабораторном пластике (Ogawa и соавт., 1999). После открытия ЭСК человека в 1998 г. по ряду причин возник новый взрыв интереса к изучению гемопоэтических предшественников, полученных из ЭСК. Согласно опубликованным в сентябре 2001 г. результатам исследований, команда J. Thomson из Висконсинского университета в США разработала новый эффективный метод для получения гемопоэтических предшественников, которые при культивировании на неплотной поверхности и в присутствии гемопоэти ческих ростовых факторов давали начало колониям клеток миелоидного, эритроидного ростков и мегакариоцитам. Направленная дифференцировка вызывалась методом сокультивирования ЭСК человека с линиями клеток костного мозга мышей S17 или эндотелия желточного мешка С166. Гемопоэтическая дифференцировка человеческих ЭСК может иметь важное терапевтическое значение, так как обеспечивает получение в неограниченном количестве эритроцитов и тромбоцитов в целях трансфузии и гемопоэтических стволовых клеток для трансплантации. Эти клетки могут быть скринированы на наличие патогенных организмов и генетически изменены для лечения специфических заболеваний. Получение гемопоэтических стволовых клеток из ЭСК человека, способных к приживлению в тканях реципиента, приведет не только к усовершенствова нию современных методов лечения рака крови, но и станет в руках ученых инструментом для предотвра щения иммунного отторжения других тканей, полученных из ЭСК (Thomson и соавт., 2000). Применение трансплантации гемопоэтических предшественников для достижения толерантности к органным трансплан татам изучается уже с 50-х годов ХХ века. Недавние исследования показали, что аллотрансплантация очищенных гемопоэтических стволовых клеток мышей препятствует иммунному отторжению пересаженных тканей, разделяющих то же генетическое происхождение. Экспериментальные данные, полученные на приматах и человеке, подтверждают свойство гемопоэтических химер приобретать толерантность, которая обеспечивает приживление трансплантированных органов без длительной терапии иммунодепрессантами. Таким образом, полученные в результате направлен ной дифференцировки ЭСК человека гемопоэтиче ские стволовые клетки могут создать гематологический химеризм у пациента, организм которого станет толерантным к другим трансплантатам, полученным из той же линии ЭСК. Трансплантация в данном случае не потребует продолжительного медикаментозного подавления иммунного ответа. Данный метод может стать альтернативой терапевтическому клонированию, внедрение которого вызывает каскад этических проблем, само по себе является дорогостоящим и технически сложно выполнимым. Перспективы применения ЭСК ЭСК млекопитающих представляют собой потенциально неисчерпаемый источник дифференцирован ных нетрансформированных клеток с нормальным кариотипом для исследователей, занятых изучением функционирования специфических типов тканей при патологии и в норме. Хотя малигнизированные линии человеческих клеток в целом общедоступны для экспериментирования, однако наблюдается недостаток в первичных диплоидных культурах отчасти из-за ограниченного периода репликативной жизни таких клеток и сложностей в их культивировании. Проект по расшифровке генома человека (Human Genome Project) подошел к концу и теперь начинается вторая стадия, которая предусматривает идентификацию функций новых генов. Так как ЭСК человека и других млекопитающих способны к неограничен ной пролиферации в культуре и выдерживают направленные генетические изменения, они являются превосходной системой для определения функций человеческих генов в течение дифференцировки и в терминально дифференцированных клетках. ЭСК человека могут оказаться весьма привлекательным источником материала для аллотранспланта ции. С их применением станет возможным получать чистые популяции одного типа клеток, которые после трансплантации смогут заместить собственные клетки пациента, подвергшиеся дегенерации или деструкции (табл. 2). Таблица 2. Потенциальное применение терапевтическо го клонирования*
* — Robert Lanza et al. Prospects for the use of nuclear transfer in human transplantation. Nature Biotechnology 1999; 17: Dec. В разразившемся ажиотаже вокруг ЭСК человека не стоит забывать о широких возможностях, представляемых "взрослыми" стволовыми клетками. Из-за благоприятствования в области законодательства и удовлетворительного финансирования потенциал использования ЭСК в клеточной терапии активно изучается в США, Австралии, Израиле и Великобритании (в последней, кстати сказать, известному биологу А. Smith в Эдинбурге так и не удалось вывести культуру ЭСК человека, хотя Великобритания и претендует сегодня на роль "Мекки биотехнологий", что свидетельствует о непростоте задачи). В большинстве европейских стран с консервативным законодательством продолжают активно изучать свойства пластичности "взрослых" стволовых клеток. Например в Германии, в Дюссельдорфском университете, 46-летнему пациенту, перенесшему в 2001 г. инфаркт миокарда, было введено через катетер несколько миллионов стволовых клеток, полученных из его же костного мозга. В результате через 10 нед величина инфаркта уменьшилась на одну треть, и работа сердца заметно улучшилась. Это было представлено в виде настоящей сенсации. Достоверно установлено, что в опытах на мышах с индуцирован ным инфарктом после трансплантации стволовых клеток костного мозга удается восстановить до 68% поврежденной ткани. "Взрослые" стволовые клетки (гемопоэтические стволовые клетки костного мозга) уже рутинно применяются для лечения лейкемии. Двум тысячам человек во всем мире были трансплантированы гемопоэтические стволовые клетки пуповины. Таким образом, еще предстоит решить, какое направление в трансплантационных технологиях является наиболее перспективным. Но очевидно следующее: человеческие ЭСК предлагают новую модель для понимания процессов, которые контролируют развитие человеческого организма. Биология развития млекопитающих стремительно двигается вперед, и гены, которые регулируют различные ступени развития, уже определены или будут идентифицированы в ближайшее время, а это значит, что возможность направлять развитие ЭСК в один-единственный тип клеток не так далека. И.А. Гривенников, А.А. Шкуматов Институт молекулярной генетики РАН, Москва |