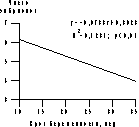Редукция числа развивающихся плодов при многоплодной беременности — шестилетний опыт.
|
В последние два десятилетия получили широкое распространение вспомогательные репродуктивные технологии (ВРТ), что привело к значительному увеличению частоты многоплодной беременности в популяции. При индукции овуляции частота многоплодия варьирует от 16 до 39% [1], а при ЭКО она достигает 23% и зависит от количества переносимых эмбрионов [2]. Актуальной проблемой применения методов ВРТ является существенное повышение частоты развития беременностей с числом плодов три и более. Известно, что вынашивание беременности при многоплодии сопряжено со значительным увеличением частоты осложнений со стороны матери, а высокий уровень преждевременных родов у этой группы пациенток приводит к увеличению перинатальной и ранней детской заболеваемости и смертности, что позволяет считать многоплодную беременность патологической [3].
В литературе описаны отдельные случаи успешного рождения большого количества плодов, как, например, рождение "флорентийской шестерки" [4]. Однако результаты оценки перинатальных потерь при многоплодной беременности однозначно свидетельствуют о значительном увеличении этого показателя пропорционально числу развивавшихся плодов. Уровень перинатальной смертности среди троен достигает 16%, при этом в течение периода новорожденности смертность среди троен составляет 15%. При четырех- и пятиплодной беременности эти показатели равны соответственно 21 и 22%. При шестиплодной беременности погибают 41% плодов и 50% новорожденных [5]. В целях улучшения исходов при беременности большим количеством плодов была предложена операция редукции числа плодов при многоплодной беременности (РПМБ). Впервые РПМБ в I триместре беременности путем введения под контролем ультразвукового исследования раствора KCl в область сердца редуцируемого плода описали R. Berkowitz и соавт. [6], методика которых получила наибольшее распространение в мире. Несмотря на более чем десятилетний опыт применения РПМБ в I триместре многоплодной беременности, весьма актуальным остается ряд вопросов, касающихся методики выполнения этой операции, оценки ее клинической эффективности, установления критериев выбора плодов перед проведением РПМБ, а также определения влияния операции на дальнейшее течение беременности и состояние плодов, продолживших свое развитие. Решение этих вопросов, связанных с РПМБ, позволяющей снизить уровень перинатальной заболеваемости и смертности при многоплодии, явилось основной целью настоящего исследования. Материал и методы Обследовано 150 женщин, у которых выполнены 184 операции РПМБ (основная группа). Средний возраст пациенток составил 34,4±5,8 года. У всех женщин беременность наступила после лечения длительного бесплодия методами ВРТ. В результате лечения у всех пациенток развивалась многоплодная беременность двумя плодами и более. У 3 женщин многоплодие возникло после стимуляции овуляции, у 6 — после искусственной инсеминации и у остальных (у 141) — после выполнения ЭКО. На момент вмешательства срок беременности у пациенток был от 9 до 13 нед и в среднем (M±SD) составил 10,5±0,8 нед. У 24 женщин РПМБ была выполнена при сроке беременности 9 нед, у 67 — при сроке 10 нед, у 37 — при сроке 11 нед, у 14 — при сроке 12 нед, у 9 — при сроке 13 нед. В табл. 1 представлено распределение числа пациенток, которым была выполнена РПМБ, в зависимости от исходного и окончательного числа развивающихся плодов при беременности. У 91,3% женщин целью вмешательства было уменьшение числа развивающихся плодов до двух. У 13 (8,7%) беременных произведена редукция числа развивающихся плодов до одного. Основным методом родоразрешения обследованных женщин было кесарево сечение (79%), большинство операций было произведено в плановом порядке. Основанием для планового оперативного родоразрешения являлась совокупность относительных показаний: неправильное положение плодов и длительное бесплодие в анамнезе у первородящих старшего возраста. Проведен ретроспективный анализ течения беременности и ее исходов у 58 пациенток при многоплодной беременности после ЭКО, которым РПМБ не выполнялась (группы сравнения), в том числе у 10 женщин с трехплодной беременностью (1-я группа) и у 48 — с двухплодной (2-я группа). Достоверных различий в возрасте, данных анамнеза и способе родоразрешения по сравнению с основной группой обследованных женщин выявлено не было. Ультразвуковые и допплерометрические исследования проведены на ультразвуковом диагностическом приборе SSD-2000 фирмы "ALOKA" (Япония). Для точной визуализации сосудов и оценки кровотока в функциональной системе мать—плацента—плод, после получения информированного согласия, проводилось цветное допплеровское картирование. Мощность ультразвукового излучения не превышала 100 мВт/см. Всем пациенткам непосредственно перед проведением инвазивного вмешательства выполнялось ультразвуковое исследование, при котором определяли число плодов, тип плацентации многоплодной беременности, величину копчико-теменного размера (КТР) плодов. Кроме того, у всех плодов определяли величину толщины воротникового пространства (ТВП). До и после выполнения РПМБ при допплерометрическом исследовании у плодов определяли частоту сердечных сокращений (ЧСС), индекс пульсации (ИП) и максимальную систолическую скорость кровотока в артерии пуповины, величину ИП кровотока в средней мозговой артерии, аорте и венозном протоке плода, величину ИП и систолодиастолическое отношение кровотока в прехориальных спиральных ветвях маточных артерий, а также значение ИП кровотока маточных артерий у обследованных женщин [7]. Все внутриматочные вмешательства выполняли в амбулаторных условиях под ультразвуковым контролем, с применением методов асептики и антисептики. Получение информированного согласия супружеской пары на проведение вмешательства являлось обязательным. РПМБ осуществляли трансабдоминально по оригинальной двухигольной методике [8]. У 8 пациенток в связи с наличием увеличения ТВП у 10 плодов выполнена трансабдоминальная биопсия ворсин хориона с последующим кариотипированием [9]. Результаты исследований обработаны общепринятыми методами параметрической и непараметрической статистики, корреляционного анализа, линейными и нелинейными методами множественного регрессионного анализа, оценку значимости которого проводили при помощи общепринятых таблиц. Сравнение данных проведено с использованием критерия Стьюдента, Вилкоксона—Манна—Уитни и Пирсона (c). Различия признаков считались достоверными при 95% уровне значимости (p<0,05). Результаты и обсуждение К настоящему времени накопленный опыт ведения многоплодной беременности свидетельствует о том, что риск акушерских осложнений напрямую зависит от числа развивающихся плодов. Использование стимуляции суперовуляции при ВРТ, а также перенос в матку более чем одного эмбриона после ЭКО привели к значительному увеличению частоты многоплодной беременности тремя и более плодами [10—13]. Анализ продолжительности беременности у 138 пациенток после ЭКО, которым был проведен перенос от 4 до 7 эмбрионов, выявил достоверную отрицательную корреляционную зависимость между числом перенесенных в матку эмбрионов и продолжительностью беременности (рис. 1).
Рис. 1. Зависимость между числом эмбрионов, перенесенных в матку при ЭКО, и продолжительностью многоплодной беременности. Существуют два пути, позволяющие снизить частоту развития многоплодия при применении ЭКО. Первый, однозначно более предпочтительный как с медицинской, так и с этической точки зрения — отказ от переноса более одного эмбриона и внедрение метода криоконсервации остальных эмбрионов и их перенос при последующих менструальных циклах, при отсутствии наступления беременности у пациентки [10, 14]. Второй путь предотвращения "супермногоплодия" — выполнение редукции числа развивающихся плодов. Первоначальный опыт применения РПМБ был накоплен при ее проведении во II триместре беременности, в связи с выявленными у одного из плодов врожденными или наследственными заболеваниями. В дальнейшем, в связи с резким увеличением многоплодия и необходимостью улучшить течение и исходы беременности РПМБ начали проводить в I ее триместре [5, 6, 15, 16]. Наиболее оптимальным периодом для выполнения этой операции считается 10—13 нед беременности. До этого срока существует вероятность самопроизвольной редукции одного или большего числа плодов — возникновение феномена "vanishing twin syndrome", что исключает необходимость внутриматочного вмешательства. Кроме того, потенциальная вероятность поперечных редукций конечностей и оромандибулярных гипоплазий у новорожденных, матерям которых проводились внутриматочные вмешательства до 9 нед беременности, также влияет на выбор времени выполнения этой операции [6, 17—19]. В нашем исследовании ни одного случая поперечных редукций конечностей или оромандибулярных гипоплазий у новорожденных отмечено не было. Очевидной проблемой при проведении РПМБ являлось отсутствие обоснованных критериев выбора плода перед выполнением вмешательства. Комплексное решение этой задачи необходимо по следующим соображениям. Повышенный риск развития врожденных и наследственных болезней при многоплодной беременности определял необходимость исключения хромосомной патологии у развивающихся плодов, что обеспечивалось проведением пренатальной диагностики с использованием инвазивных внутриматочных вмешательств. Однако наряду с высокой диагностической эффективностью пренатального кариотипирования данный подход существенно увеличивает риск перинатальных потерь в связи с необходимостью проведения нескольких внутриматочных интервенций. В последнее время значительное внимание в современной перинатологии уделяется неинвазивным ультразвуковым методам диагностики нарушений развития плода. Наиболее информативным ультразвуковым маркером хромосомных заболеваний плода и структурных нарушений его развития является определение ТВП плода в I триместре беременности [20, 21]. Таблица 1. Число пациенток, которым была выполнена РПМБ, в зависимости от исходного и окончательного числа развивающихся плодов при беременности
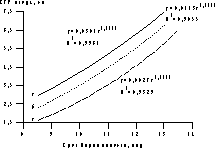
* — Пятиплодная беременность при двух самопроизвольно редуцировавшихся плодах до выполнения РПМБ. ** — Четырехплодная беременность при одном самопроизвольно редуцировавшемся плоде до выполнения РПМБ. Нами проведено измерение ТВП у 471 плода 150 беременных женщин, и только у 10 (2,1%) плодов (у 8 (5,3%) женщин) выявлено значение ТВП более 2,5 мм. Несмотря на то, что проведение пренатального кариотипирования не выявило хромосомной патологии у плодов, все они были подвергнуты редукции, учитывая взаимосвязь патологического увеличения толщины воротникового пространства и врожденных заболеваний у плода, в частности пороков сердца [22]. Анализ отдаленных результатов показал, что ни у одного из новорожденных, у которых на ранних сроках беременности ТВП была в пределах нормальных значений, не было выявлено хромосомных заболеваний или структурных нарушений развития. Таким образом, эти результаты подтверждают высокую эффективность данного метода для исключения врожденных нарушений развития плода и позволяют рекомендовать использование этого ультразвукового маркера при многоплодии как одного из основных критериев для отбора плодов перед РПМБ в I триместре беременности. Другим принципиально важным аспектом ведения многоплодной беременности является снижение частоты осложнений, связанных с типом зиготности, или плацентации. При монохориальной многоплодной беременности значителен риск развития плодово-плодового трансфузионного синдрома, приводящего к увеличению перинатальных потерь. В связи с этим тип плацентации был определен как один из критериев отбора плодов перед проведением редукции их числа в I триместре многоплодной беременности [23]. По нашему мнению, особенности развития плодов и функциональных систем мать—плацента—плод при многоплодии уже в I триместре беременности имеют специфический характер, влияющий на ее течение и исход. Так, величина КТР плодов при многоплодии при одном и том же сроке беременности оказалась подвержена достаточно большим колебаниям. Установленная зависимость величины плода от срока многоплодной беременности была использована для разработки номограммы (рис. 2), позволяющей получить информацию об относительном отставании в развитии того или иного плода и применять эти нормативные данные при отборе плодов перед выполнением РПМБ. Результаты показали, что, несмотря на абсолютно одинаковый период внутриутробного развития плодов при многоплодии, уже к концу I триместра беременности имеет место диссоциация их развития, которая, вероятно, связана с особенностями плацентации и развития хориона, а также с характером кровоснабжения в различных отделах матки.
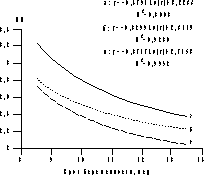
Рис. 2. Процентильное распределение величины КТР плода в I триместре многоплодной беременности. а — 5-я процентиль; б — 50-я процентиль; в — 95-я процентиль Данные исследования гемодинамики в функциональных системах мать—плацента—плод позволили разработать номограммы допплерометрических показателей кровотока в основных артериальных сосудах фетоплацентарной системы и венозном протоке плода, а также маточных артериях у женщин на протяжении I триместра многоплодной беременности. Допплерометрические исследования, проведенные у каждого из плодов перед выполнением РПМБ, выявили достоверные корреляционные зависимости между величиной КТР плода и показателями кровотока в артерии пуповины. У плодов с наибольшей величиной КТР сосудистое сопротивление кровотоку в артерии пуповины было наименьшим (рис. 3), а скорость кровотока достоверно превосходила таковую у плодов с меньшей величиной КТР. Аналогичные закономерности были выявлены и при исследовании кровотока в аорте и мозговых артериях плода. Кроме того, были установлены достоверные различия показателей кровотока в прехориальных спиральных ветвях маточных артерий в месте плацентации плодов, имеющих различные величины КТР, что свидетельствует о наличии относительного повышения периферического сосудистого сопротивления кровотоку в материнской части хориальной циркуляции наименьших плодов.
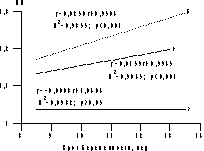
Рис. 3. Динамика ИП в артерии пуповины у наименьших (а) и наибольших (б-2; в-1) плодов в I триместре многоплодной беременности. Оценка венозного кровотока плода позволяет получить дополнительные характеристики состояния гемодинамики в фетоплацентарной системе. В течение всей беременности венозный проток обеспечивает непрерывное снабжение головного мозга плода наиболее оксигенированной кровью. Известно, что изучение характера кровотока в венозном протоке на протяжении I триместра беременности может оказать помощь в диагностике патологии развития сердечно-сосудистой системы плода и стать дополнительным маркером хромосомных заболеваний [24, 25]. В нашем исследовании только у одного плода был выявлен ретроградный кровоток в венозном протоке, и, учитывая патологический характер венозного кровотока, он был подвергнут редукции. В I триместре многоплодной беременности показатели кровотока в венозном протоке достоверно различались у наибольших и наименьших плодов (рис. 4). Кроме того, у наименьших плодов они увеличивались на протяжении I триместра, в то время как у наибольших плодов практически не изменялись. Это, в свою очередь, приводило к достоверному увеличению средних значений ИП в венозном протоке плода на протяжении I триместра многоплодной беременности по сравнению с характером изменений кровотока в венозном протоке плода при неосложненной одноплодной беременности [26]. Это позволяет полагать, что различия условий гемодинамики в функциональных системах мать—плацента—плод в I триместре беременности при многоплодии являются одной из возможных причин диссоциированного развития плодов. При этом величина КТР может рассматриваться как интегральный показатель условий развития плода, а ее относительное уменьшение по отношению к таковым у других плодов является признаком диссоциации их развития, которую необходимо учитывать при отборе плодов перед РПМБ.
Рис. 4. Сравнение динамики ИП в венозном протоке между наибольшими (а) и наименьшими (б) плодами в I триместре многоплодной беременности. в — среднее значение при многоплодной беременности. В результате комплексного анализа проведенных исследований разработан алгоритм необходимого обследования при многоплодии перед РПМБ (рис. 5), согласно которому основными критериями отбора плодов являются нарушения развития плода, выявленные при ультразвуковом исследовании, тип плацентации многоплодной беременности: КТР плода как интегральный показатель развития плода. Допплерометрическое исследование кровотока в артерии пуповины, венозном протоке плода и прехориальных спиральных ветвях маточных артерий позволяет установить дополнительные признаки диссоциированного развития плодов при многоплодии и произвести физиологически обоснованный выбор плода для выполнения его редукции. Важным аспектом исследования степени безопасности любого вмешательства во время беременности является оценка степени его влияния на состояние плода и всей фетоплацентарной системы в целом. Наши результаты показали, что выполнение операции РПМБ не оказывает влияния на функциональное состояние развивающихся плодов: по сравнению с исходными значениями после операции достоверных изменений ЧСС плодов и показателей гемодинамики в их артерии пуповины выявлено не было, достоверно не различались показатели венозной гемодинамики. Заслуживает внимание и тот факт, что при отсутствии изменений характера кровотока в прехориальных спиральных ветвях маточных артерий в области плацентации развивающихся плодов значительно повышалось сосудистое сопротивление в подобных сосудах в области плацентации редуцированных плодов, после остановки их фетоплацентарного кровотока. Эти данные еще раз подтверждают положение проф. Н.Л. Гармашевой о тесной взаимозависимости маточно-плацентарного и фетоплацентарного кровообращения [27]. Нами прослежены ближайшие результаты развития беременности в течение 4 нед после выполнения операции РПМБ. Только в 3 (2%) случаях у пациенток после выполнения РПМБ была зарегистрирована внутриматочная гибель развивающихся плодов и/или прерывание беременности. Эти данные в сочетании с результатами исследования гемодинамики в функциональных системах мать—плацента—плод у развивающихся плодов после выполнения РПМБ позволяют считать данную операцию относительно безопасной по отношению к дальнейшему развитию многоплодной беременности. Кроме того, наши данные показали возможность выполнения этого вмешательства в амбулаторных условиях, что позволяет снизить затраты при ведении беременности у женщин, нуждающихся в его применении.
Рис. 5. Алгоритм отбора плода перед выполнением РПМБ. Таблица 2. Сравнение исходов многоплодной беременности после РПМБ и без ее выполнения
Примечание. Звездочками отмечена достоверность p<0,01 (c-тест) при сравнении с данными 2-й группы (одна звездочка) и с данными 1-й и 2-й групп (две звездочки). Известно, что клиническая характеристика групп пациенток, у которых беременность наступила спонтанно, в результате ЭКО или в результате гормональной терапии, имеет специфические различия [2, 10, 28]. Характерными особенностями пациенток в нашем исследовании являются возраст старше 30 лет, длительное и безуспешное лечение по поводу бесплодия различной этиологии, различные оперативные вмешательства на органах репродуктивной системы в их анамнезе. Несомненно, что эти факторы могли оказать влияние на течение беременности и ее исход. В настоящее время показано, что беременность, развивающаяся у женщин после ЭКО, имеет меньшую продолжительность по сравнению со спонтанной, и при многоплодии срок родоразрешения женщин редко превышает 35—36 нед [29—32]. Наши результаты показали, что после выполнения РПМБ средняя продолжительность беременности у всех обследованных женщин при рождении жизнеспособных детей составила 35,5±2,7 нед (M±SD). У пациенток с развивавшейся двойней, которые составили абсолютное большинство обследованных, продолжительность беременности равнялась 35,2±2,6 нед. Нами не выявлено достоверных различий в сроке родоразрешения пациенток после РПМБ до двойни при изначально трех- или четырехплодной беременности. Все женщины, у которых в результате РПМБ развивалась одноплодная беременность, были родоразрешены в срок. Однако у тех, которым проводилась редукция одного плода из двойни, срок родоразрешения одноплодной беременности был больше по сравнению с этим показателем у женщин, у которых проводили редукцию двух плодов из тройни. Не выявлено зависимости между продолжительностью беременности и временем выполнения РПМБ в период с 9-й по 13-ю неделю беременности. Установлено (табл. 2), что при многоплодной беременности после выполнения РПМБ частота прерывания беременности до 28 нед не превышала популяционную и составила менее 5%. По данным ретроспективного анализа, этот показатель был меньше по сравнению с таковым при многоплодной беременности после ЭКО без выполнения РПМБ. Все женщины, вынашивавшие трехплодную беременность, родили глубоконедоношенных детей с низкой массой тела. Средний срок родоразрешения (M±SD) составил в 1-й группе — 31,7±2,9 нед, во 2-й группе — 36,9±2,4 нед, в основной группе — 35,2±2,6 нед. Анализ уровня перинатальных потерь показал следующее: начиная с 28-й недели беременности и до рождения внутриутробной гибели плодов не было. В 1-й группе сравнения в результате преждевременных родов из 9 новорожденных умерли двое, масса тела которых была 1370 и 1470 г. Во 2-й группе из 78 новорожденных умер ребенок — масса тела 1290 г. Из 174 новорожденных основной группы при двойне погиб 1 ребенок — масса тела 1410 г. Причинами смерти явились тяжелая внутриутробная пневмония, осложнившаяся ДВС-синдромом, синдром дыхательных расстройств и кровоизлияние в желудочки мозга. Таким образом, уровень перинатальной смертности в 1-й группе — 222,2‰‰‰, во 2-й группе — 12,8‰‰‰, в основной группе — 5,8‰‰‰. Эти показатели достоверно различаются между собой (c-тест, р<0,001). Выявлено, что после РПМБ преждевременные роды у женщин с развивающейся двойней происходили чаще, чем у женщин с двойней после ЭКО, которым эта операция не выполнялась. Однако в нашем исследовании имели значение различные условия наблюдения за течением беременности у женщин, перенесших РПМБ. Так, более 60% пациенток после операции наблюдались в различных городах и областях России и Белоруссии, причем в последней — в основном в сельских районах. Оказалось, что у женщин, проживавших в Санкт-Петербурге, срок родоразрешения составил 36,7±2,7 нед (M±SD) и был достоверно (р<0,05, парный t-тест) больше, чем у женщин, проживавших в Белоруссии (34,7±2,5 нед), и на 1 нед — чем у женщин, проживавших в городах и областях России. Можно полагать, что в Санкт-Петербурге условия наблюдения за течением беременности и комплекс лечебных мероприятий для такой группы женщин были более оптимальными. Анализ исходов беременности в исследованных группах пациенток показывает, что РПМБ позволяет увеличить продолжительность многоплодной беременности, тем самым существенно снижая уровень перинатальных потерь. Таким образом, проведенное исследование позволило изучить развитие плодов на ранних сроках многоплодной беременности и на основании клинико-патофизиологических исследований обосновать применение операции редукции числа плодов в I триместре с целью улучшения ее перинатальных исходов. Заключение 1. РПМБ в конце I триместра беременности является относительно безопасным вмешательством, не оказывающим влияния на состояние развивающихся плодов, позволяющим снизить перинатальную смертность при многоплодии до 5,8‰‰‰. 2. Уже в I триместре беременности при многоплодии существуют начальные признаки диссоциированного развития плодов, которые могут быть выявлены при комплексном ультразвуковом и допплерометрическом исследовании. 3. Критериями отбора плодов перед выполнением РПМБ являются увеличение ТВП у плода, тип плацентации, наименьшая величина плода, различия артериальной и венозной гемодинамики в функциональных системах мать—плацента—плод. 4. Исходы беременности у женщин после выполнения РПМБ зависят от количества эмбрионов, перенесенных в матку при ЭКО, и условий наблюдения за течением беременности. 5. С целью снижения частоты наступления многоплодия большим числом плодов при использовании ЭКО целесообразно проводить перенос в матку не более двух эмбрионов. А.В. Михайлов, А.Л. Коротеев, Э.В. Исакова, Д.М. Киссин, А.В. Новикова, В.С. Прохорова, Н.Н. Константинова Научно-исследовательский институт акушерства и гинекологии им. Д.О. Отта РАМН, Международный центр репродуктивной медицины, Санкт-Петербург Литература 1. Hobbins J.C. Selective reduction — a perinatal necessity? N Engl J Med 1988; 318: 16: 1062—1063. 2. Корсак В.С. Экстракорпоральное оплодотворение в терапии бесплодия: Автореф. дис. ... д-ра мед. наук. Ст-Петербург 1999; 31. 3. Weissman A., Talmon R., Jakobi P. The outcome of abdominally delivered triplets and twins: a matched case-control study. Eur J Obstet Gynecol Reprod Biol 1998; 79: 2: 123—125. 4. Giovannucci-Uzielli M.L., Vecchi G., Donzelli G.P. et al. The history of the Florentine sextuplets: obstetric and genetic considerations. Prog Clin Biol Res 1981; 69A: 217—220. 5. Botting B.J., Davies I.M., McFarland A.J. Recent trends in the incidence of multiple births and associated mortality. Arch Dis Child 1987; 62: 941—50. 6. Bercowitz R.L., Lynch L., Chitkara U. et al. Selective reduction of multifetal pregnancies in the first trimester. N Engl J Med 1988; 318: 1043—1047. 7. Mikhailov A.V., Kissin D., Koroteev A. Multifetal pregnancy reduction: method of selection and results. XV Nordic Cong. Perinat. Med. Turku 1997; Abstr: 34—35. 8. Михайлов А.В. Внутриматочные вмешательства под ультразвуковым контролем во время беременности. Клиническое руководство по ультразвуковой диагностике. Т.II. Под ред. В.В. Митькова и М.В. Медведева. М: Видар 1996; 280—302. 9. Михайлов А.В., Лебедев В.М., Корсак В.С. и др. Инвазивные вмешательства под ультразвуковым контролем в I триместре беременности в целях пренатальной диагностики заболеваний плода и лечения при осложнениях беременности. Вестник Российской ассоциации акушеров-гинекологов 1997; 3: 63—68. 10. Brinsden P.R. A Textbook of In vitro Fertilization and Assisted Reproduction. New York: Parthenon Publ. Gr. 1999; 564. 11. Hecht B.R. The impact of assisted reproductive technology on the incidence of multiple gestation. Multiple pregnancy. Eds. L.G. Keith, E. Papernik, D.M. Keith, B. Luke. New York 1995; 175—190. 12. Hu Y., Maxson W.S., Hoffman D.I. et al. Maximizing pregnancy rates and limiting higher-order multiple conceptions by determining the optimal number of embryos to transfer based on quality. Fertil Steril 1998; 69: 4: 650—657. 13. Medical research international. Society for assisted reproductive technology-American fertility society. In vitro fertilization — embryo transfer (IVF-ET) in the United States: 1990 results from the IVF-ET registry. Fertil Steril 1992; 57: 15—24. 14. Cohen J., DeVane G.W., Elsner C.W. et al. Cryopreservation of zygotes and early cleaved human embryos. Fertil Steril 1988; 49: 283—289. 15. Evans M.I., Fletcher J.C., Zador I.E. et al. Selective first-trimester termination in octuplet and quadruplet pregnancies: clinical and ethical issues. Obstet Gynecol 1988; 71: 289—296. 16. Kanhai H.H.H., van Rijssel E.J.H.C., Meerman R.J. et al. Selective termination in quintuplet pregnancy during first trimester. Lancet 1986; 1: 1447—1448. 17. Dolk H., Bernard F., Leshat M.F. Chorionic villus sampling and limb abnormalities. Lancet 1992; 339: 876—877. 18. Firth H.V., Boyd P.A., Chamberline P. et al. Severe limb abnormalities after chorion villus sampling at 56—66 days gestation. Lancet 1991; 337: 762—763. 19. Landy H.J., Weiner S., Corson S.L. et al. The "vanishing twin": Ultrasonographic assessment of fetal disappearance in the first trimester. Am J Obstet Gynecol 1986; 155: 14—19. 20. Nicolaides K.H., Azar G., Byrne D. et al. Fetal nuchal translucency: ultrasound screening for chromosomal defects in first trimester of pregnancy. Br Med J 1992; 304: 867—869. 21. Pajkrt E., Mol B.W.J., van Lith J.M.M. et al. Screening for Down's syndrome by fetal nuchal translucency measurement in a high-risk population. Ultrasound Obstet Gynecol 1998; 12: 156—162. 22. Ultrasound markers for fetal chromosomal defects. Eds. R.J.M. Snijders and K. Nicolaides. New York: Parthenon 1996; 194. 23. Koroteev A.L., Prokhorova V.S., Novikova A.V. et al. Combine ultrasound and Doppler examination for selection before fetal reduction. Arch Perinat Med 1999; 5: 1: 17—18. 24. Коган И.Ю., Полянин А.А., Лебедев В.М. и др. Особенности спектра кровотока в венозном протоке как маркера хромосомной патологии у плода: клиническое наблюдение и обзор литературы. Ультразвук диагн 1999; 7: 3: 238—242. 25. Matias A., Montenegro N., Areias J.C. et al. Anomalous fetal venous return associated with major chromosomopathies in the late first trimester of pregnancy. Ultrasound Obstet Gynecol 1998; 11: 209—213. 26. Коган И.Ю. Становление венозного кровообращения в фетоплацентарной системе в течение нормально развивающейся беременности: Автореф. дис. ... канд. мед. наук. Ст-Петербург 1999; 19. 27. Гармашева Н.Л. Плацентарное кровообращение. Л: Медицина 1967; 243. 28. Корсак В.С., Аржанова О.Н., Пайкачева Ю.М. Особенности течения многоплодной беременности в программе экстракорпорального оплодотворения. Акт вопр физиол и патол репрод функц женщины: Мат XXVI научн. сес. НИИАГ им. Д.О. Отта РАМН. Под ред. Э.К. Айламазяна. Ст-Петербург 1999; 51—55. 29. Koudstaal J., Bruinse H.W., Helmerhorst F.M. et al. Obstetric outcome of twin pregnancies after in vitro fertilization: a matched control study in four Dutch University hospitals. Hum Reprod 2000; 15: 4: 935—940. 30. Melgar C.A., Rosenfeld D.L., Rawlinson K., Greenberg М. Perinatal outcome after multifetal reduction to twins compared with nonreduced multiple gestations. Obstet Gynecol 1991; 78: 5: l: 763—767. 31. Pietrzak P., Powolny M., Grzybowski W. et al. Multiple pregnancy: a clinical study. Arch Perinat Med 1999; 1: 5: 39—44. 32. Yaron Y., Bryant-Greenwood P.K., Dave N. Multifetal pregnancy reduction of triplets to twins: comparison with nonreduced triplets and twins. Am J Obstet Gynec 1999; 180: 5: 1268—1271. |