Особенности гормонального статуса у женщин с абдоминально-висцеральным и глютеофеморальным ожирением.
|
Ожирение является одним из самых распространенных заболеваний населения экономически развитых стран, где четверть населения имеет массу тела, более чем на 15% превышающую норму [1]. Наличие ожирения приводит к нарушениям репродуктивной функции женщин или отягощает уже имеющиеся отклонения [2].
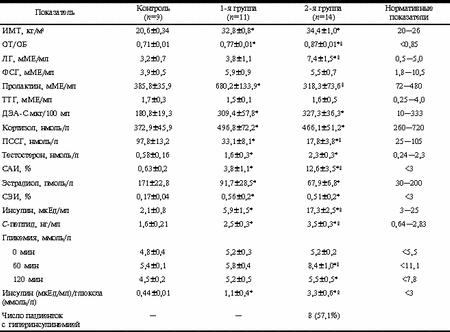
Согласно существующим данным [3, 4, 5], риск развития заболеваний, связанных с ожирением, зависит не столько от степени избытка массы тела, сколько от характера распределения жировой ткани, формируюшего глютеофеморальный (гиноидный) и абдоминально-висцеральный (андроидный) типы ожирения [6]. Выявлена зависимость между характером распределения жировой ткани и наличием метаболических осложнений. Считается, что андроидный тип ожирения чаще сочетается с инсулинорезистентностью и гиперинсулинемией, дислипидемией и артериальной гипертензией, гиперандрогенией и гирсутизмом, составляя основу метаболического синдрома [7]. В настоящее время интенсивно изучается роль андроидного типа ожирения в патогенезе хронической ановуляции при синдроме поликистозных яичников (СПКЯ) [8—11] и гиперплазии эндометрия [12]. Выявлены основные метаболические и гормональные нарушения, сопровождающие наличие андроидного ожирения и приводящие к нарушениям репродуктивной функции. При этом остается неясным, какие нарушения в деятельности эндокринной системы характерны для женщин с гиноидным типом ожирения. Поэтому целью настоящего исследования явилась сравнительная оценка гормонального статуса пациенток с гиноидным и андроидным типами ожирения. Материал и методы В обследование включено 25 пациенток репродуктивного возраста с ожирением, обратившихся в Центр репродуктивной медицины с нарушениями менструальной и репродуктивной функции, и 9 женщин с нормальной массой тела, составивших контрольную группу. Обследованные женщины не получали каких-либо гормональных препаратов на протяжении 3 месяцев до проведения исследования. Средний возраст пациенток составил 32±3 года. Всем пациенткам проводилась оценка антропометрических параметров: массы тела, индекса массы тела (ИМТ), который рассчитывали как отношение массы тела (в кг) к длине тела (в м), возведенной в квадрат [13]; окружности талии (ОТ), окружности бедер (ОБ) и их соотношения. По отношению ОТ/ОБ пациентки с ожирением разделились на 2 группы: 1-я группа — гиноидный тип (ОТ/ОБ < 0,85; n=11) и 2-я группа — андроидный тип (ОТ/ОБ > 0,85; n=14) [14]. Концентрацию гормонов в сыворотке крови определяли радиоиммунологическим методом с использованием стандартных наборов реактивов фирм: "Immunotech" (Чехия) — определение ЛГ, ФСГ, пролактина, ТТГ, дегидроэпиандростерона сульфата (ДЭА-С), С-пептида; ГП "ХОП ИБОХ" (Беларусь) — определение тестостерона, эстрадиола, кортизола, инсулина; "BCM Diagnostics" (США) — определение глобулина, связывающего половые стероиды (ПССГ). Индексы свободных андрогенов (САИ) и свободных эстрогенов (СЭИ) рассчитывали как отношение уровней общего тестостерона или эстрадиола к уровню ПССГ и выражали в %. За норму принимали нормативные показатели фирм-изготовителей. У больных с сохраненной менструальной функцией обследование выполняли в первую фазу менструального цикла. Всем пациенткам проводили стандартный тест на толерантность к глюкозе. Кровь брали натощак, через 1 и 2 часа после приема 75 г глюкозы. За нормативные показатели приняты данные ВОЗ [15]. Статистическую обработку результатов, выраженных в виде M±m, проводили по методу вариационной статистики с применением коммерческого пакета программ "Biostat". Результаты Данные проведенного обследования женщин с ожирением свидетельствуют о том, что выраженная дисфункция эндокринной системы характерна для обоих типов ожирения. Особенности гормонального и метаболического профилей групп представлены в таблице. Согласно полученным данным, у пациенток 1-й (ОТ/ОБ < 0,85) и 2-й (ОТ/ОБ > 0,85) групп отмечена более высокая, чем в группе сравнения, секреция инсулина и С-пептида, что сочеталось с повышенными, по сравнению с контролем, уровнями гликемии на 60-й и 120-й минутах глюкозотолерантного теста во 2-й группе обследуемых. В обеих группах женщин с ожирением выявлена тенденция к повышению содержания инсулина, С-пептида, тестостерона, ДЭА-С, кортизола и свободных фракций половых стероидов при снижении уровней ПССГ и эстрадиола. Изменения показателей инсулина, С-пептида, тестостерона, его свободной фракции и ПССГ были более выражены во 2-й группе женщин. Обращает на себя внимание более высокий уровень пролактина в группе женщин с гиноидным типом ожирения (680,2±133,9 мМЕ/мл) по сравнению с женщинами 2-й группы (318,3±73,6 мМЕ/мл). Особенности гормонального и метаболического профилей пациенток с разными типами ожирения
Примечание. * — достоверные различия с контрольной группой (р меньше 0,01); — достоверные различия между группами больных с ожирением (р меньше 0,05). Обнаружено повышение ЛГ в группе с андроидным типом ожирения 7,4±1,5 мМЕ/мл против 3,8±1,1 мМЕ/мл в 1-й группе. Обсуждение Проведенный анализ полученных результатов позволил нам сделать вывод, что определяющим в состоянии здоровья обследованных женщин является степень повышения уровня секреции инсулина у пациенток с ожирением. В нашем исследовании индексы массы тела в 1-й и 2-й группах не имели принципиальных отличий. В обеих группах отмечены качественно однотипные гормональные и метаболические нарушения, включая гиперинсулинемию и инсулинорезистентность. Тенденция к снижению содержания уровня ПССГ у женщин с ожирением была более выражена во 2-й группе, что сопровождалось закономерным подъемом свободных фракций тестостерона при увеличении его общего пула в обоих случаях. Повышение уровня тестостерона отмечалось на фоне измененного уровня ЛГ у женщин с андроидным типом ожирения. Известно, что инсулин может непосредственно подавлять продукцию ПССГ печенью, вследствие чего снижение уровня ПССГ может расцениваться как маркер гиперинсулинемии и инсулинорезистентности [14, 16]. Поскольку ПССГ является главным транспортным белком для половых стероидных гормонов, в частности — тестостерона, то снижение его уровня приводит к повышению свободных и, следовательно, биологически активных фракций половых стероидов, о чем свидетельствуют полученные нами данные об увеличении показателя индекса свободных андрогенов. Согласно существующим данным, в жировой ткани происходит ускорение ароматизации андрогенов в эстрон и эстрадиол с последующим развитием гиперэстрогении [17]. В нашем исследовании среднее содержание эстрадиола в сыворотке крови больных с обоими типами ожирения было ниже, чем у здоровых женщин, хотя и не выходило за пределы существующих нормативных показателей. При этом наблюдалось повышение индекса свободных эстрогенов. Нами установлена положительная корреляция между ИМТ, уровнем инсулина и содержанием тестостерона (r=0,87) в обеих группах сравнения. В группе женщин с андроидным типом ожирения выявлена положительная связь между уровнями инсулина и свободных андрогенов (r=0,85) и отрицательная корреляция между содержанием инсулина и ПССГ (r=_0,84). Этим объясняется взаимосвязь обнаруженных нарушений стероидогенеза и гиперинсулинемии у больных с ожирением обоих типов с преобладанием этих изменений во 2-й группе сравнения. Помимо выявленных нарушений в метаболизме половых стероидов нами обнаружены более высокие, чем в контроле, показатели ДЭА-С и кортизола в обеих группах обследованных больных. Полученные результаты согласуются с данными о нарушении функции гипоталамо-гипофизарно-надпочечниковой системы на фоне ожирения [18], для которого характерны повышенный клиренс кортизола и усиление функции надпочечников, ведущее к увеличению продукции надпочечниковых андрогенов, а также общего пула андрогенов [19]. Следует отметить наличие положительной корреляции между ИМТ и уровнями ДЭА-С (r=0,74) в обеих группах, не зависящей от характера распределения жира. Это подтверждает ведущую роль ожирения как такового, независимо от типа, в формировании дисфункции гипоталамо-гипофизарно-надпочечниковой системы. Повышение уровня пролактина при нормальной секреции ТТГ в 1-й группе женщин, по сравнению со 2-й, может свидетельствовать о вкладе нарушений метаболизма биогенных аминов в гипоталамических структурах мозга в формирование гиноидного типа ожирения, что требует проведения дальнейших исследований. Заключение В нашей работе выявлены однотипные нарушения метаболического и гормонального статуса у пациенток с гиноидным и андроидным типами ожирения, отличающиеся лишь в количественном выражении. Положение осложняется тем, что выявленные индивидуально измененные уровни гормонов при гиноидном типе ожирения могут находиться в пределах нормативных показателей, используемых клиницистами. В последнее время внимание гинекологов в большей мере занято изучением различных аспектов метаболического синдрома при висцерально-абдоминальном типе ожирения, поскольку в группе больных с глютеофеморальным ожирением выраженные нарушения репродуктивной функции встречаются реже. Однако полученные данные свидетельствуют о том, что любой тип ожирения представляет собой эндокринную патологию и должен рассматриваться как фактор риска в развитии заболеваний, обусловленных метаболическим синдромом: онкологических заболеваний, болезней сердца и сосудов, сахарного диабета и др. А.В. Светлаков, М.В. Яманова, Н.А. Махалова, О.С.Филиппов Красноярская государственная медицинская академия, Центр репродуктивной медицины, Красноярск Литература 1. Bray G. Complications of obesity. Ann Intern Med 1985; 103: 1052—1062. 2. Wolf A. et al. Obesity — significance in adolescence and for reproduction. Zentralbl Gynakol 1998; 120: 5: 210—222. 3. Van Hallie T. The problem of obesity. Health implications of overweight and obesity. Ann Intern Med 1985; 103: 6: 981—1051. 4. Kissehah A. et al. Relation of body fat distribution to metabolic complications of obesity. J Clin Endocrin 1982; 54: 254—260. 5. Norman R. et al. Obesity and reproductive disorders: a review. Reprod Fertil Dev 1998; 10: 1: 55—63. 6. Татонь Я. Ожирение. Патофизиология, диагностика, лечение. М: Медицина 1981; 210. 7. Reaven G. Diabetes 1988; 37: 1595—1607. 8. Nestler J. et al. Role of obesity and insulin in development of anovulation. In: Ovulation induction. Ed. by M. Filicori and C. Flamigni. Elsevier Science B.V. 1994; 103—113. 9. Nestler J. Obesity, insulin, sex steroids and ovulation. Int J Obes Relat Metab Disord 2000; 24: 2: 71—73. 10. Kirsner M. et al. Androgen — estrogen in obese women. J Clin Endocrin and Metab 1990; 70: 2: 473—479. 11. Poretsky L. et al. The gonadotropic function of insulin. Endocr Rev 1987; 8: 2: 132—141. 12. Чернуха Г.Е. Аденоматозная и железистая гиперплазия эндометрия в репродуктивном возрасте (патогенез, клиника, лечение): Автореф. дис. ... … д-ра мед. наук. М 1999; 10. 13. Сметник В.П., Тумилович Л.Г. Неоперативная гинекология. М 1995; 161—165. 14. Speroff L., Glass R., Kase N. Clinical gynecologic endocrinology and infertility. 5-th ed. Williams & Wilkins 1994. 15. Всемирная организация здравоохранения: Комитет экспертов ВОЗ по сахарному диабету. Второй доклад. М: Медицина 1985; 90. 16. Nestler J.E. Sex hormone-binding globuline: a marker for hyperinsulinemia and/or insulin resistance? J Clin Endocrin Metab 1993; 76: 273—274. 17. Whiworth N.S., Meeks G. Hormone metabolism: body weight and extraglandular estrogen production. Clin Obstet Gynec 1985; 28: 3: 580—587. 18. Терещенко И.В. Патогенетическое обоснование лечения ожирения. Пробл эндокрин 1993; 6: 18—21. 19. Клиническая эндокринология: Руководство. Под ред. Н.Т. Старковой. М: Медицина 1991; 29. Семинар. Лечение бесплодия: нерешенные проблемы 4—7 сентября 2001 г., Саратов Российская ассоциация репродукции человека Министерство здравоохранения Саратовской области Саратовский областной центр планирования семьи и репродукции Предварительная программа Организация лечебно-диагностической помощи при бесплодном браке Эндокринное бесплодие у женщин (поликистозные яичники, метаболический синдром, заболевания щитовидной железы) Мужское бесплодие Иммунология репродукции Генитальный эндометриоз и бесплодие ИППП и бесплодие — мнение репродуктолога Вспомогательные репродуктивные технологии: — современные подходы к индукции суперовуляции — эмбриологический этап — проведение контроля качества лаборатории Репродуктивная хирургия Репродуктивная генетика, пренатальная диагностика Восстановление фертильности у женщин позднего репродуктивного возраста Перинатальные проблемы после вспомогательных репродуктивных технологий Медико-психологическое консультирование при бесплодии Донорство ооцитов, юридические аспекты вспомогательных репродуктивных технологий VII ежегодная конференция Российской ассоциации репродукции человека Тел. 8452 _ 52-49-48, Факс: 8452 - 50-91-51, E-mail: oсpsr@intsar.com |